ATVB郭峻莉团队与合作者发现Suv39h1下调HIC1转录调节VSMC表型转化介导血管狭窄
2025年5月1日,海南医科大学郭峻莉教授团队与南京师范大学杨玉玉副教授合作在Arterioscler Thromb Vasc Biol上发表了题为“Suv39h1 Regulates Phenotypic Modulation of Smooth Muscle Cells and Contributes to Vascular Injury by Repressing HIC1 Transcription”的研究论文。Suv39h1((suppressor of variegation 3-9 homolog 1))是组蛋白赖氨酸甲基转移酶,可特异性修饰H3K9发生三甲基化,导致染色质的紧密结构,抑制基因的表达。本论文报道了Suv39h1通过抑制HIC1表达,促进平滑肌细胞向合成型表型转化介导血管狭窄。

首先,研究者发现C57BL/6小鼠接受颈动脉结扎手术后,损伤侧动脉中Suv39h1表达水平显著上调,在Apoe-/-小鼠喂食西方饮食12周后其主动脉中Suv39h1的表达水平也显著升高,而都伴随收缩标记物SM22a水平降低,但未观察到Suv39h2表达的显著变化。这些结果说明Suv39h1而不是Suv39h2与VSMC收缩特性的降低存在正相关关系。使用siRNA转染人原代主动脉平滑肌细胞并用PDGF-BB处理,发现Suv39h1的沉默部分逆转了PDGF-BB诱导的收缩基因下调,并且显著抑制了VSMCs的细胞增殖和迁移能力。说明Suv39h1促进VSMC向合成型转化。
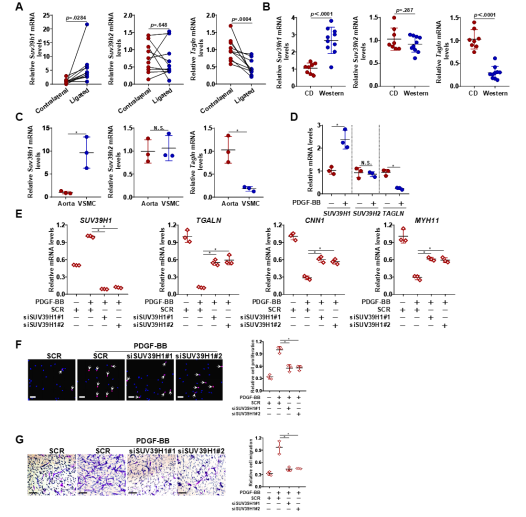
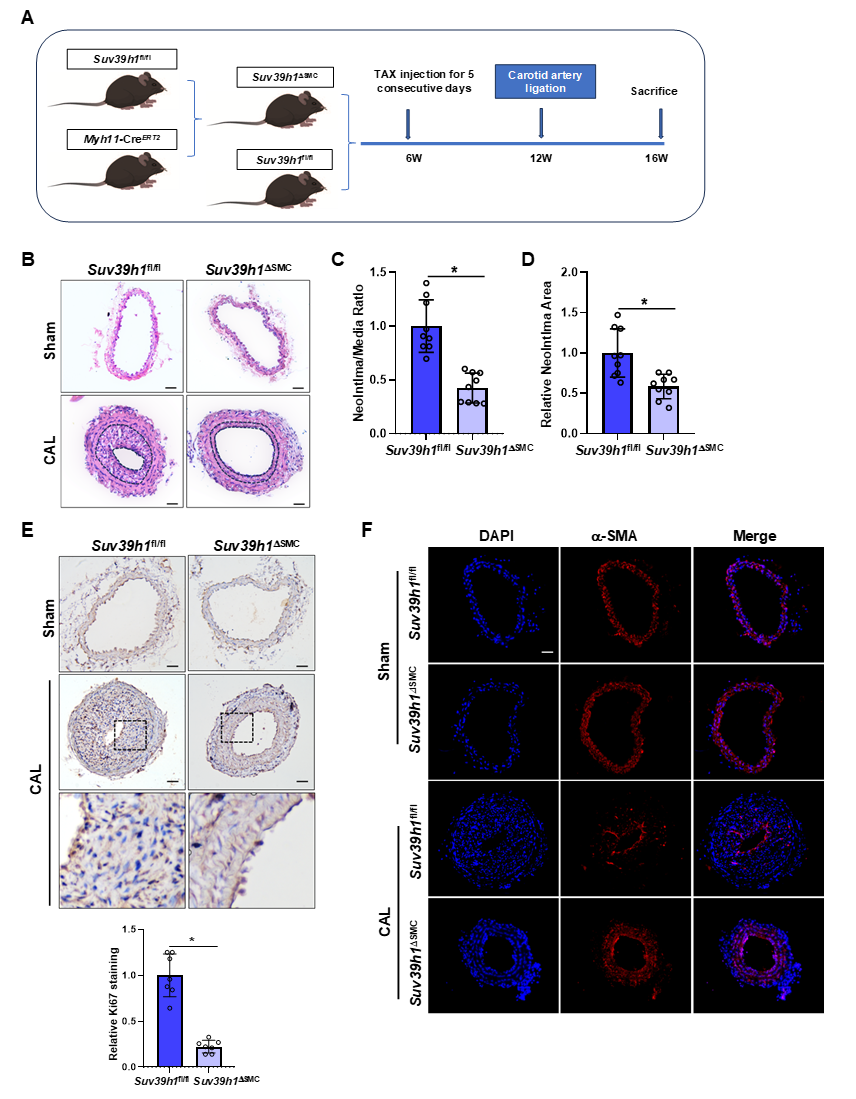
接着,研究者构建了平滑肌细胞Suv39h1特异性敲除(Suv39h1DSMC)小鼠,发现颈动脉结扎或股动脉穿刺手术之后,相比对照组, Suv39h1DSMC小鼠中Suv39h1的缺失减少了损伤动脉中新生内膜形成,降低了内膜/中膜比率和相对新生内膜面积,VSMC表现为增殖能力降低、收缩标记蛋白增加。
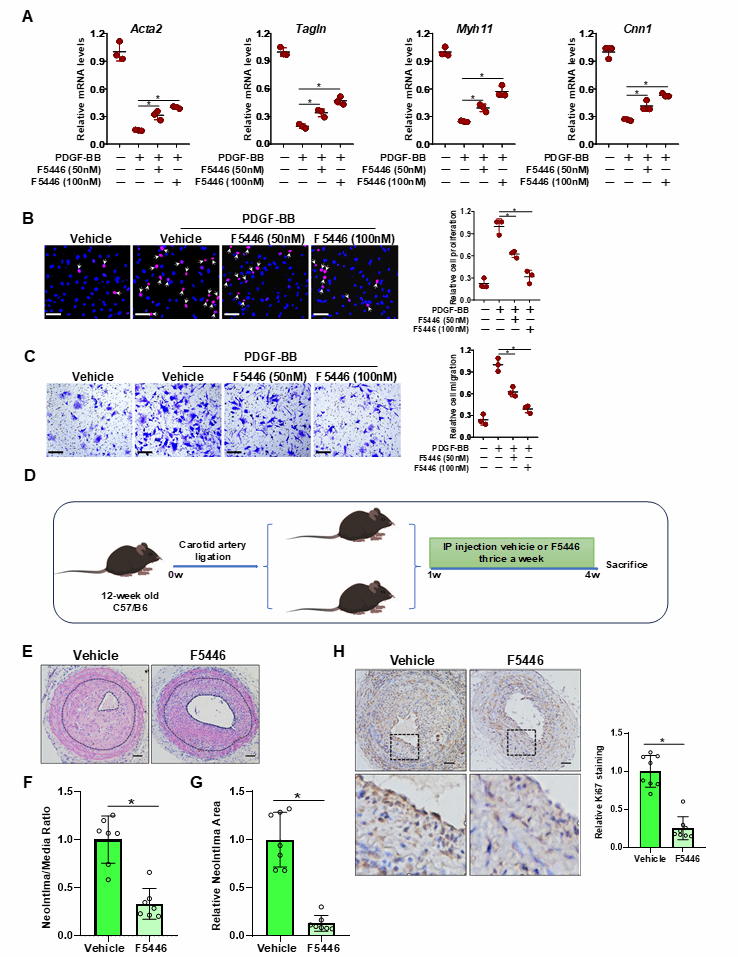
使用Suv39h1小分子抑制剂F5446(H3K9甲基化酶特异性抑制剂)与PDGF-BB共同处理VSMCs后,F5446显著减轻了PDGF-BB对收缩基因表达的抑制作用,并减弱了细胞增殖和迁移能力。C57BL/6小鼠接受颈动脉结扎手术后,与对照组相比,给予F5446显著减轻了小鼠损伤动脉中的内膜增生,且抑制了VSMCs增殖,并保护收缩基因表达。
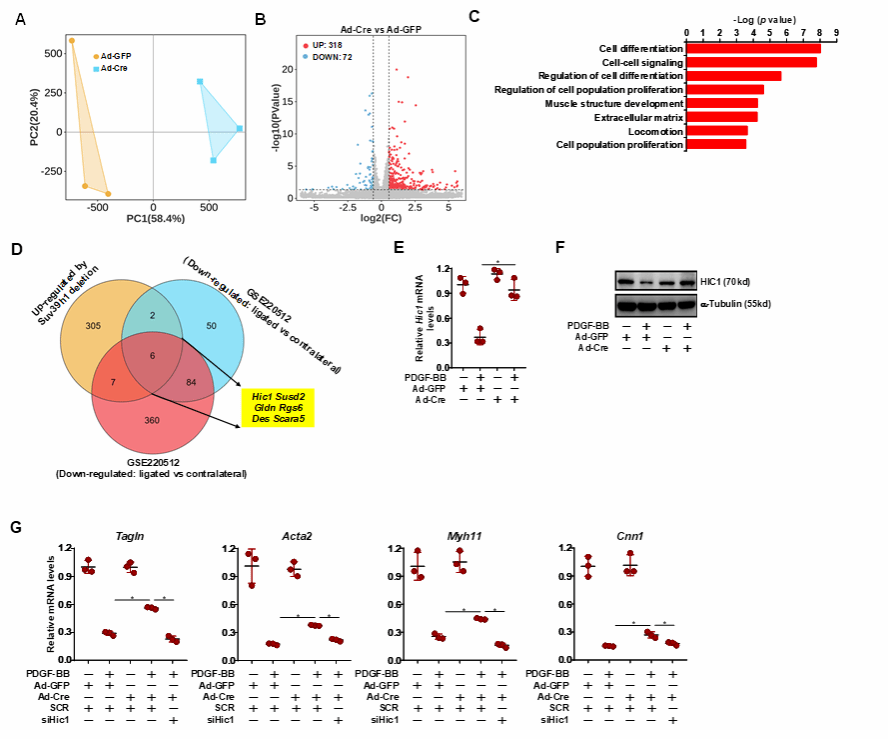
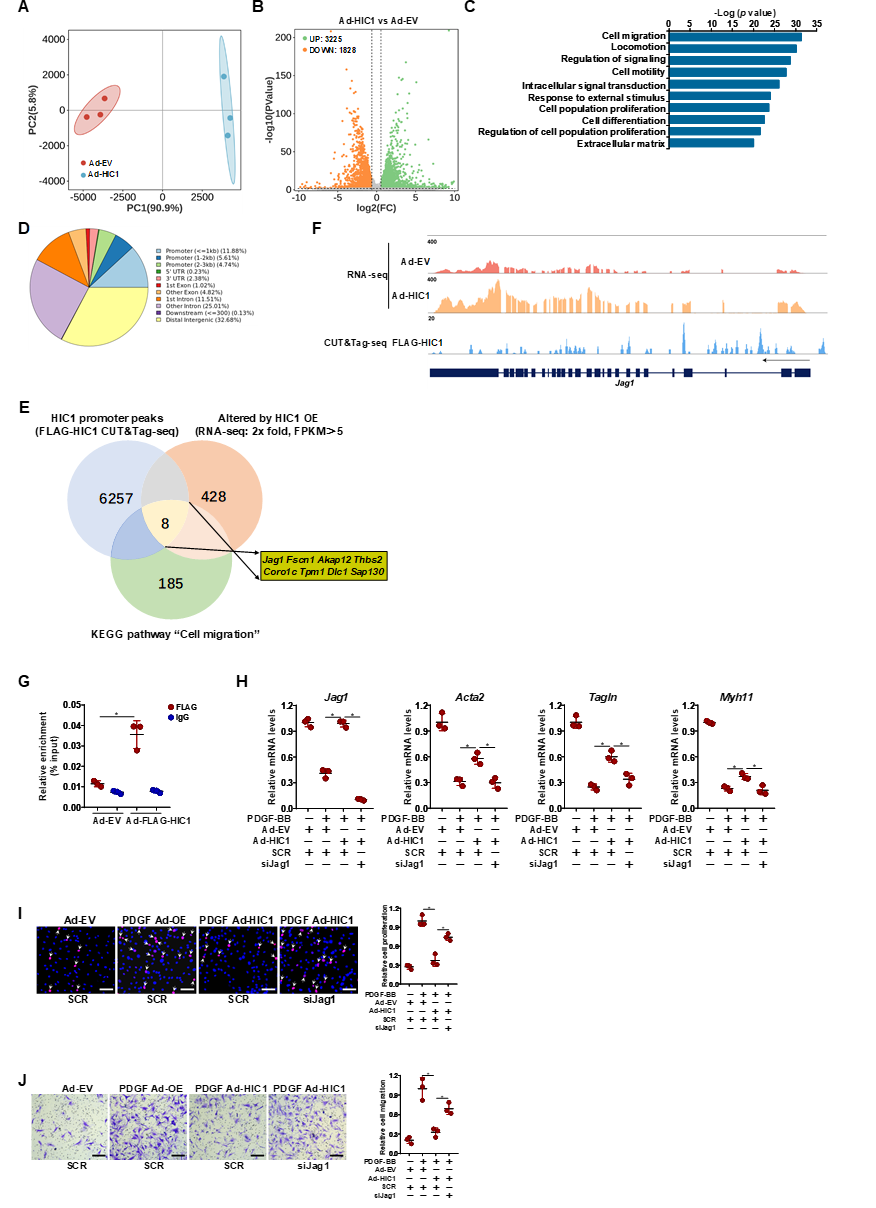
利用RNA-seq实验揭示HIC1为Suv39h1的潜在靶基因,HIC1表达在血管损伤和Suv39h1缺失条件下上调。VSMCs中Suv39h1基因敲除或被F5446抑制后,HIC1表达恢复正常。siRNA沉默HIC1和Suv39h1或沉默HIC1同时给予F5446,可逆转Suv39h1缺失的效应。
HIC1过表达减轻了PDGF-BB对VSMCs收缩基因表达的抑制,并抑制细胞增殖和迁移。利用AAV9病毒载体尾静脉注射VSMC特异性的HIC1过表达载体,发现HIC1的过表达在体内显著抑制了新生内膜的形成。
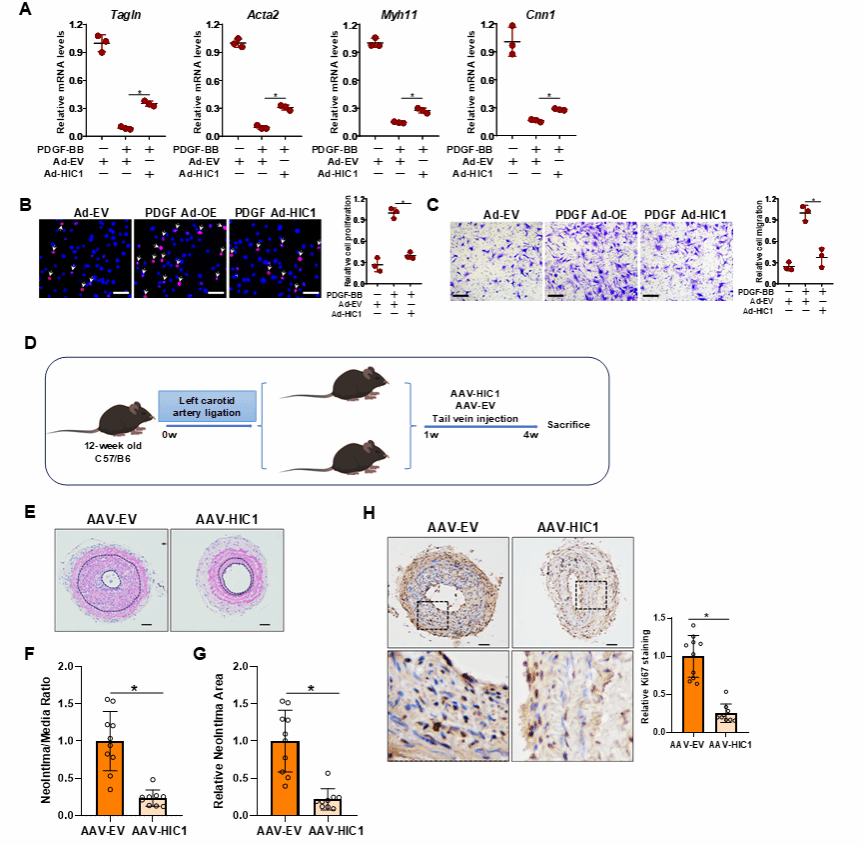
RNA-seq和CUT&Tag实验将潜在的HIC1靶基因范围缩小至8个,其中Jag1基因位列首位。ChIP分析结果证实了HIC1与VSMCs中Jag1基因启动子区域直接结合。在VSMCs中,HIC1的过表达部分逆转了PDGF-BB对收缩基因表达的抑制作用,而Jag1基因的沉默则抵消了这一效应,同时也逆转了HIC1对细胞增殖和迁移的抑制效果。这说明HIC1抑制VSMC迁移和增殖依赖于激活Jag1转录,而Jag1作为Notch配体抑制VSMCs的迁移和增殖。
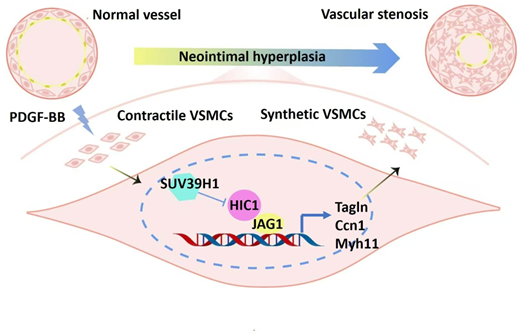
总之,研究者新发现了平滑肌细胞中Suv39h1 在血管损伤时表达上调,并抑制HIC1-Jag1信号通路,从而促进VSMC的迁移和增殖,进而促进血管狭窄。本文新发现Suv39h1是血管损伤的新调节因子,Suv39h1可作为干预再狭窄的新靶点。
南京师范大学杨杨玉玉副教授、中国药科大学张秋梅博士、海南医科大学刘帅博士为共同第一作者,海南医科大学郭峻莉教授为通讯作者。研究得到了国家自然科学基金、江苏省优势学科、海南省重点研发计划和海南省自然科学基金等资助。
原文链接:https://pubmed.ncbi.nlm.nih.gov/40308197/

