近日,海南医科大学热带转化医学教育部重点实验室王洪亮教授团队在国际病原学顶级期刊(中国科学院一区top)《PLOS Pathogens》上发表题为《Disrupted glycosylphosphatidylinositol anchoring induces ER stress and restricts enterovirus infection》的研究论文。该研究通过全基因组CRISPR筛选,首次揭示了糖基磷脂酰肌醇锚定系统在肠道病毒感染过程中的关键作用,并阐明了其通过诱导内质网应激及激活RIDD通路降解病毒RNA的新机制。

研究亮点
1. 发现GPI锚定系统为多种肠道病毒的关键宿主因子
研究团队通过CRISPR/Cas9筛选,发现GPI锚定合成与转移相关基因(如PIGS、PIGK等)是埃可病毒7、EV71、柯萨奇病毒B5等多种肠道病毒感染所必需的。这些基因不仅影响病毒进入受体CD55的表达,更在病毒复制和复制细胞器形成中发挥关键作用。
2. 揭示GPI系统通过调控内质网完整性来影响病毒复制
研究发现,破坏GPI锚定系统会导致内质网形态异常并引发内质网应激,进而激活IRE1α通路。特别值得注意的是,该通路并未引发典型的XBP1可变剪接,而是启动了RIDD途径,选择性降解肠道病毒RNA,从而限制病毒复制。
3. 阐明病毒UTR区域是RIDD识别的关键
进一步实验表明,肠道病毒的非翻译区是其对GPI系统破坏敏感的关键结构。研究人员构建了多种UTR报告系统,对5′UTR和3′UTR在其中的功能进行分析,综合病毒非结构蛋白表达系统的数据,最终证明5′UTR区介导了病毒RNA在RIDD作用下的降解。
4. 提出“相对成熟的GPI锚或前体分子积累触发RIDD”的新模型
研究还发现,只有在GPI锚定合成的后期阶段被阻断时才会激活RIDD,提示相对成熟的GPI锚或前体分子的积累是触发该通路的关键信号,为理解内质网应激的脂质调控机制提供了新视角。
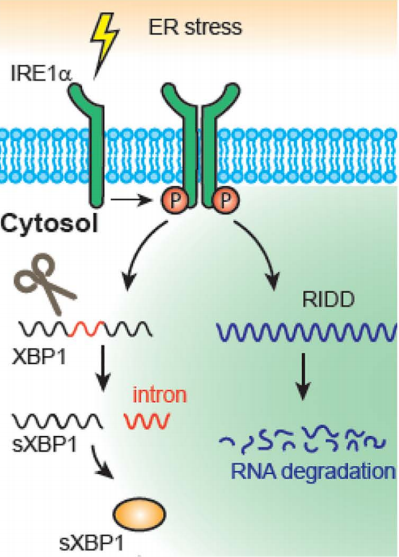
该研究不仅揭示了GPI锚定系统在病毒复制中的多重功能,还首次将内质网应激的RIDD通路与抗病毒天然免疫联系起来,为理解病毒—宿主相互作用提供了全新视角。研究成果为进一步开发针对肠道病毒及其他相关病毒的新型抗病毒策略奠定了理论基础。
实验室简介
热带转化医学教育部重点实验室依托海南医科大学,巩固和发展心血管与代谢疾病、肿瘤生物学、神经科学、热带病原与免疫生物学、干细胞与再生医学五大核心方向。实验室拥有一支高水平的科研团队,致力于从基础研究到临床应用的全程创新,已在多种病毒性疾病的致病机制和防控策略方面取得系列重要成果。
论文信息:
Shangrui Guo, Xinyu Li, Meng Xun, Yingli He, Andrew W. Tai, Hongliang Wang.
Disrupted glycosylphosphatidylinositol anchoring induces ER stress and restricts enterovirus infection.
PLOS Pathogens, 2025. https://doi.org/10.1371/journal.ppat.1013685.
