1. 杨献文团队和合作者从深海真菌中发现首个靶向SHN3治疗骨丢失的活性先导化合物
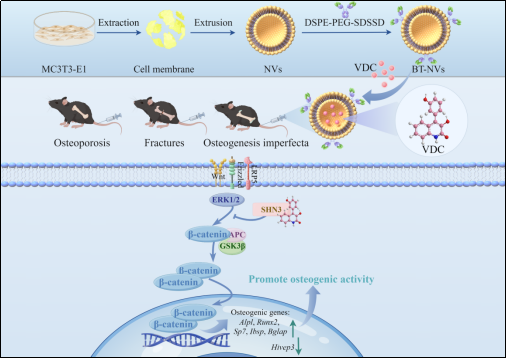
4月7日,海南省医学科学院杨献文研究员团队与厦门大学许韧教授课题组合作,从已构建的海洋微生物天然化合物库(CoLMM)中选择251种深海真菌来源的化合物进行活性测试,发现喹啉酮生物碱viridicatol(VDC)可通过靶向Wnt/SHN3信号通路显著促进成骨分化,有效缓解骨质疏松,加速骨折愈合并改善成骨不全症。相关成果以“Viridicatol from the Deep-Sea-Derived Fungus Alleviates Bone Loss by Targeting the Wnt/SHN3 Pathway”为题发表在《Advanced Science》上。该发现创新性构建了“海洋药物-骨靶向递送-遗传性骨病干预”的全链条解决方案,为骨质疏松、骨折修复及成骨不全症的治疗提供了全新范式。

Schnurri-3(SHN3)是调控骨合成代谢“开关”靶点,短期抑制SHN3可显著增强成骨细胞活性、提升骨量。然而,目前尚无靶向SHN3发挥治疗作用的化合物。团队通过独创的“ALP活性表型/SHN3基因调控”双维度筛选体系,对CoLMM中的251种深海天然化合物进行活性测试,发现VDC能高效促进小鼠骨髓间充质干细胞(BMSCs)及颅盖骨成骨细胞系MC3T3-E1的矿化能力,显著增强成骨分化。进一步机制研究表明,VDC通过结合SHN3蛋白,激活Wnt信号通路下游GSK-3β和ERK的磷酸化,促使β-连环蛋白积累,进而上调成骨标志基因(Alpl、Runx2、Ibsp、Bglap、SP7)表达,最终驱动成骨分化进程。在卵巢切除诱导的骨质疏松小鼠模型中,VDC治疗显著提升骨密度并修复骨微结构;同时,在骨折模型中,VDC表现出加速骨痂形成和愈合的潜力。
针对严重成骨不全(Col1a2oim/oim模型)的复杂骨病,团队创新性将海洋天然化合物与生物纳米技术结合,研发骨靶向纳米囊泡(BT-NVs)递送系统,通过骨靶向肽SDSSD偶联的成骨细胞膜生物纳米囊泡特异性识别骨组织,实现VDC的高效靶向递送,显著缓解成骨不全的骨丢失,为复杂骨病的精准治疗提供了新策略。
该成果以海南医科大学为第一作者单位,我校基础医学与生命科学学院谢春兰副研究员为第一作者,厦门大学叶商辉博士和乐昱廷硕士为共同第一作者。杨献文研究员、许韧教授和李娜助理研究员为共同通讯作者。研究受到国家自然科学基金等项目资助。
2.何祖平团队通过微量蛋白质组学揭示唯支持细胞综合征与正常人类睾丸支持细胞蛋白表达谱差异
4月7日,海南省医学科学院何祖平团队在《Cellular and Molecular Life Sciences》在线发布了题为“Micro-proteomics reveals distinct protein profiles and SPARC/FGF2/CDH1 regulation of human Sertoli cells between Sertoli cell-only syndrome and normal men”的研究论文。该研究首次运用微量蛋白质组学技术,系统解析了唯支持细胞综合征(Sertoli cell-only syndrome, SCOS)患者支持细胞的蛋白表达谱,揭示了SPARC/FGF2/CDH1信号轴的异常调控可能引起SCOS的发生。并基于此提出SPARC可能作为SCOS的潜在诊断生物标志物及治疗靶点,为开发针对SCOS及男性不育症的精准诊疗策略提供了重要的理论依据。
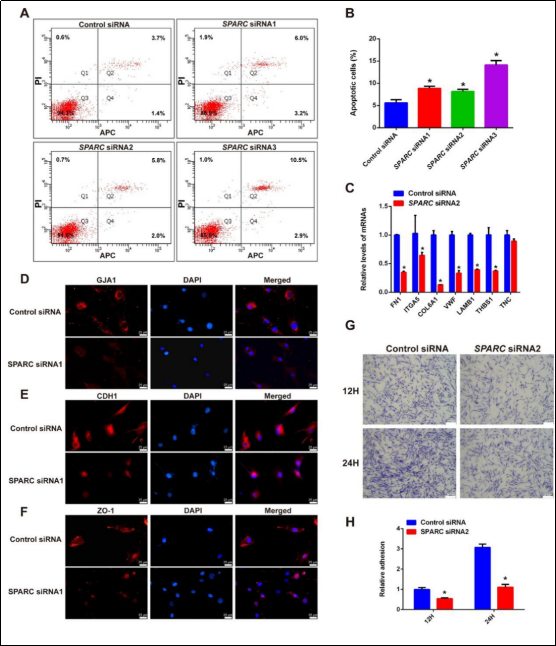
唯支持细胞综合征(SCOS)是非梗阻性无精子症(non-obstructive azoospermia, NOA)中最严重的类型之一,其特征为生精小管内仅有支持细胞而无任何生精细胞。因此揭示SCOS中睾丸支持细胞的蛋白表达谱对该疾病的诊疗策略具有重要意义。由于获取足量人类睾丸组织困难,传统蛋白质组学难以比较SCOS患者与正常男性睾丸支持细胞的大规模蛋白质表达谱。为解决这一难题,该研究团队采用仅需1-100个细胞的微量蛋白质组学技术,揭示SCOS患者与梗阻性无精子症(OA)患者(具有正常生精功能)之间支持细胞的蛋白质组差异。微量蛋白质组学显示SCOS与OA患者睾丸支持细胞的蛋白质组存在显著差异,研究发现,在SCOS患者睾丸支持细胞中,参与细胞粘附通路的蛋白质明显下调,而与细胞凋亡有关的蛋白质则明显上调。富含半胱氨酸的酸性分泌蛋白(SPARC)蛋白与钙粘蛋白CDH1在SCOS患者睾丸支持细胞中低表达,而成纤维细胞生长因子2(FGF2)在SCOS患者睾丸支持细胞中高表达。随后,研究团队发现SPARC的敲低引起睾丸支持细胞凋亡增加,细胞黏附能力下降,SPARC的敲低导致FGF2高表达,进一步引起CDH1的表达降低。该研究全面揭示了SCOS患者睾丸支持细胞的蛋白质组学特征,并为了解SCOS的发病机制提供了新的视角。
该论文以海南医科大学为共同通讯单位,海南省医学科学院何祖平教授为该论文的最后通讯作者。研究受到国家自然科学基金等项目资助。
3. 邬强团队发表可擦除荧光成像技术实现同一个活细胞持续跟踪的研究成果
4月9日,热带医学院邬强团队在《Angewandte Chemie International Edition》上发表题为“Erasable Fluorescence Imaging Technology Enables Continuous Tracking for Identical Living Cells”的研究成果。

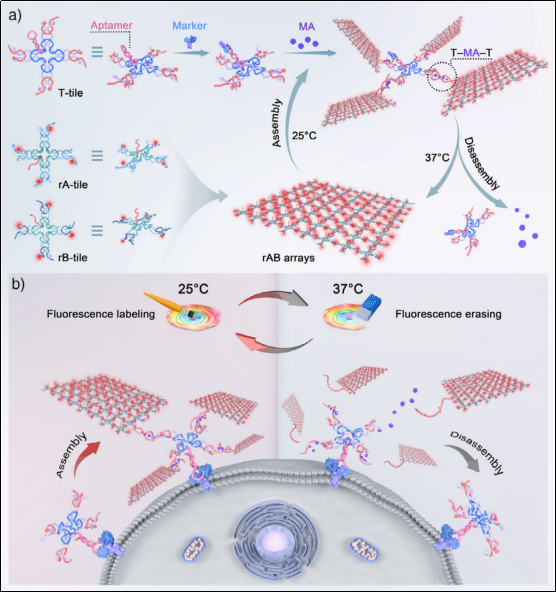
微妙的分子事件可能会引发一连串的“蝴蝶效应”,从而逆转细胞命运,因此对相关标记物的动态追踪为破译未知机制提供了重要线索。然而,现有的分析技术仍停留在静态分析层面,前沿的荧光成像技术也受限于相邻时间的信号干扰,无法实现同一个活细胞的连续观测。在上述背景下,本研究开发了一种新型的温控成像技术,通过三聚氰胺介导的可逆DNA自组装驱动荧光在任意时间点亮和熄灭,实现对同一个活细胞进行反复可擦除成像。该方法以细胞分化的动态监测为例,验证了其追踪细胞行为的能力,即时的荧光擦除既保证了成像结果的真实性,又最大限度地降低了成像体系对细胞活动的干扰。由于该方法在基础实验场景中具有很高的可行性,有望为探索细胞互作、发育转化、下游应答等方面的生物新机制提供强有力的初步筛选工具。
该研究成果以海南医科大学为唯一完成单位,彭雅南博士、硕士研究生蒲秋妹为论文共同第一作者,邬强教授为论文通讯作者。该研究受到国家自然科学基金、国家重点研发计划等项目资助。
4.朱才英及合作者首次发现“超级”造血干细胞
4月21日,海南省医学科学院青年PI朱才英与合作者在《Blood》在线发布了题为“Heterogeneity of high-potency multilineage hematopoietic stem cells and identification of ‘Super’ transplantability”的研究论文。该研究运用大规模小鼠HSC单细胞移植及连续移植实验,首次发现具有可持续跨代自我更新并维持多谱系分化潜能的“超级”HSC(Super-class HSC),并揭示“超级”HSC的分子特征。

该研究首先解析了单个HSC移植后HSC池重建的动力学和变化规律:单个HSC在移植后1个月内增殖最显著,4个月时基本达到稳态;HSC数量的增加也同时伴随转录特征的改变,且不同HSC克隆在移植后的重建水平和谱系偏向方面均呈现较大的异质性。于是,研究团队追踪288只小鼠单个HSC移植后1–4个月造血重建轨迹,发现单个HSC移植后呈现3种不同重建模式,即高水平重建和均衡谱系分化的P1型、相对低水平重建但均衡谱系分化的P2型和低水平重建和偏系分化的P3型。通过对26个HSC克隆连续移植的持续多代功能性追踪,利用团队自主开发的贝叶斯动力学数学模型“stBayes”对多代造血重建模式做系统性地分类,鉴定出“超级型”(Super-class)、“闪电型”(Flash-class)和“细流型”(Trickle-class)三类不同的HSC克隆。其中,“超级型”克隆在连续多代移植后仍可维持高水平的自我更新和多谱系重建能力。研究团队估计超级型克隆在HSC中约占4%的比例,通过单细胞转录组分析发现,超级型克隆所衍生的HSC不但高表达经典HSC基因,同时也高表达团队首次鉴定发现的“超级”特征基因群(Super DEG),并低表达“非超级”特征基因群(Non-Super DEG)。有趣的是,CD27表面标记基因是“非超级”特征基因群的成员之一。最后,研究团队通过CD27的表达水平来筛选HSC。结果显示,CD27阴性HSC在连续多代移植后仍可以维持高水平的自我更新和多谱系重建能力。通过对稳态下不同CD27表达水平的HSC进行ATAC-seq分析,团队还发现CD27表达阴性HSC的开放染色质区域富集了与干性相关的转录因子。
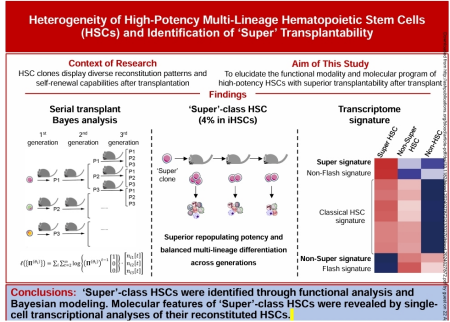
该论文以海南医科大学为共同第一作者单位,海南省医学科学院青年PI朱才英为该论文共同第一作者,中国医学科学院血液病医院(中国医学科学院血液学研究所)程涛教授、董芳研究员、陈俊仁教授和朱平研究员为共同通讯作者。
5. 邹卫国/王丽君团队发现PIEZO1-YAP1通路平衡骨膜祖细胞的成骨-肌腱分化可塑性
4月28日,海南省医学科学院再生骨科与运动医学研究所邹卫国与王丽君团队合作在《Cell Reports》在线发布了题为“Piezo1 balances the osteogenic-tenogenic plasticity of periosteal progenitor cells through the YAP pathway”的研究论文。该研究颠覆了传统认知,揭示了骨膜祖细胞在机械敏感离子通道PIEZO1缺失后向肌腱细胞谱系分化,为组织再生提供了新策略。

肌腱与骨骼均起源于中胚层间充质细胞,但传统观点认为肌腱细胞与骨骼细胞属于不可相互转化的独立谱系。骨膜是骨表面除关节外所被覆的结缔组织包膜。本研究发现骨膜中的骨骼祖细胞具有成骨与肌腱分化的双向可塑性。该研究通过Prx1 Cre(中胚层间充质干祖细胞)与OcnCre(成骨细胞)介导的Piezo1条件敲除小鼠模型比较,发现干祖细胞中Piezo1缺失显著削弱骨膜中骨骼祖细胞的成骨潜能,导致皮质骨厚度降低。单细胞转录组分析证实PIEZO1缺失使骨膜细胞停滞于祖细胞状态。既往研究表明SCX是肌腱细胞特异的转录因子。有意思的是,本研究表明骨膜中骨骼祖细胞能够被SCX标记,骨膜来源SCX+细胞与肌腱来源SCX+细胞具有不同的转录图谱,其中骨膜SCX+细胞高表达成骨相关基因,肌腱SCX+细胞高表达细胞骨架组装和纤维形成相关基因。谱系追踪与肾包膜移植实验表明,SCX+骨膜祖细胞具有成骨潜能,而PIEZO1缺失的SCX+骨膜祖细胞骨形成能力下降,导致再生修复延迟。此外,该研究还发现PIEZO1缺失可以通过激活YAP信号上调SCX表达,细胞移植实验表明骨膜干祖细胞敲除或抑制PIEZO1后可作为肌腱修复的优质细胞来源。该工作首次发现骨外膜骨骼干祖细胞具有成骨和成肌腱的两种命运抉择,且其命运决定受到机械刺激敏感蛋白PIEZO1调控,证明力学刺激具有能够优化骨骼干祖细胞参与损伤修复的能力。
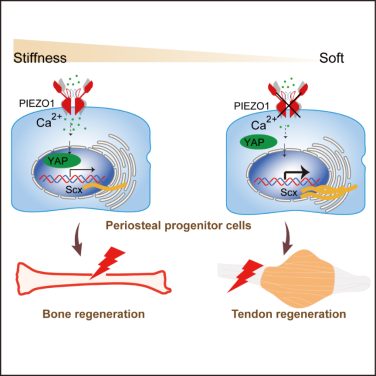
该论文以海南医科大学为第一作者单位,海南省医学科学院王丽君研究员、中国科学院分子细胞科学卓越创新中心任倩博士、海南省医学科学院博士研究生陈姝琴为该论文共同第一作者,邹卫国教授与王丽君研究员为共同通讯作者。该研究受到国家自然科学基金等项目资助。
6. 李媛媛与合作者通过正交点击化学策略设计合成一系列阳离子抗菌剂实现耐药菌的快速杀灭
3月20日,药学院李媛媛副教授与柏林自由大学Rainer Haag教授团队在《Angewandte Chemie International Edition》上发表了题为“Modular synthesis of dendritic oligo-glycerol cationic surfactants for enhanced antibacterial efficacy”的研究成果。

近年来,细菌感染性疾病发病率与死亡率持续攀升,已构成全球公共卫生安全的重大威胁。世界卫生组织数据显示,耐药菌感染每年直接导致超127万人死亡,这一数字仍在快速增长。抗生素虽为治疗此类感染的基石药物,但其长期过度使用或误用导致耐药菌进化速度远超新药研发周期,使得多重耐药菌感染患者的临床治疗成功率下降逾40%。在此背景下,开发新型抗菌药物已迫在眉睫。
阳离子抗菌剂凭借其精准的靶向作用、广谱杀菌特性及高效生物膜穿透能力,被视为应对耐药菌感染的潜力解决方案。然而,现有化合物普遍存在合成工艺复杂、细胞毒性显著等瓶颈问题,严重阻碍其规模化生产与临床转化。如何通过分子设计平衡抗菌活性与生物安全性,成为该领域亟待突破的关键科学难题。本研究采用“点击化学”与可控聚合技术,基于树枝状骨架实现寡甘油单元与阳离子基团的灵活组装,通过调整分子尺寸、电荷密度及疏水性,筛选出6种新型抗菌化合物(C12-G0、C12-G1、C12-G2、C18-G0、C18-G1、C18-G2)。经对比研究发现,C12-G1对耐甲氧西林金黄色葡萄球菌和耐药铜绿假单胞菌的最小抑菌浓度(MIC)低至0.5 μg/mL,较传统阳离子抗菌剂(如苯扎氯铵)降低10倍以上;此外,C12-G1通过静电作用靶向耐药菌生物膜并破坏脂膜结构,快速瓦解生物膜并抑制其形成,促进耐药菌感染创面的愈合且无明显的毒副作用。该研究通过仿生化设计和模块化合成策略实现了新型抗菌药物结构的精准调控,优化抗菌药物化合物库,为定制化抗菌剂开发奠定了基础。
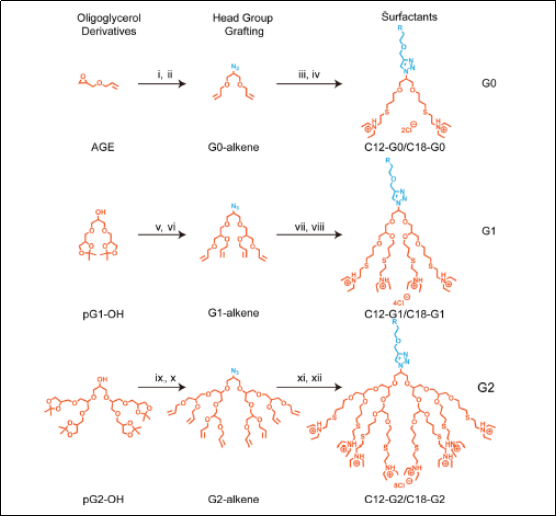
该研究成果以海南医科大学为共同通讯单位,柏林自由大学Natalie Hanheiser和姜于航博士为共同第一作者,我校药学院李媛媛副教授和柏林自由大学Rainer Haag和Abhishek K. Singh教授为共同通讯作者。该研究受到国家自然科学基金项目、海南省自然科学基金等项目资助。
