1. 郑少江团队开发了基于二氧化锰的原位疫苗同步诱导免疫原性细胞死亡和激活STING通路增强抗肿瘤免疫新策略
3月1日,第一附属医院郑少江团队与合作者在《Acta Biomaterialia》上发表了题为“Manganese dioxide-based in situ vaccine boosts antitumor immunity via simultaneous activation of immunogenic cell death and the STING pathway”的研究成果。

原位疫苗(ISV)通过诱导肿瘤部位免疫原性细胞死亡(ICD)激活抗肿瘤免疫系统,但其发展仍面临肿瘤抗原释放不足及免疫抑制微环境(TIME)等挑战。研究表明,靶向STING通路可通过启动先天免疫增强肿瘤ISV的佐剂效应。基于此,本研究开发了一种高效原位肿瘤疫苗MBMA-RGD ISV,其通过同步诱导ICD与激活STING通路实现持续抗肿瘤免疫:利用pH响应性酯键将化疗药物米托蒽醌(Mit)与光敏剂前体5-氨基酮戊酸(5-ALA)合成水溶性前药Mit-ALA,将其负载于预合成的BSA-MnO2纳米颗粒并经靶向肽Arg-Gly-Asp(RGD)功能化,最终构建MBMA-RGD ISV。该疫苗通过整合素受体介导主动靶向肿瘤细胞,并在肿瘤微环境(TME)响应下逐步释放治疗组分。释放的5-ALA在线粒体代谢生成光敏剂PpIX,激光照射下其光动力特性与Mit的光热效应协同诱导ICD,促进肿瘤抗原释放并激活适应性免疫。同时,Mn2+与Mit通过诱导DNA损伤协同激活STING通路,进一步增强抗肿瘤免疫。此外,MnO2释放的大量氧气可缓解肿瘤缺氧微环境,既增敏光动力治疗又改善TME免疫抑制状态。因此,MBMA-RGD ISV在体外和体内均能高效激活系统性抗肿瘤免疫,且未观察到明显毒副作用,为肿瘤原位疫苗开发提供新策略。
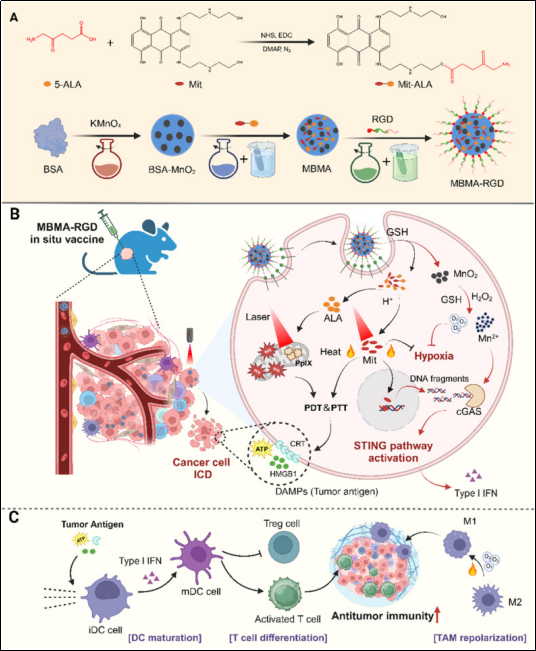
MBMA-RGD 原位疫苗策略示意图
该成果以海南医科大学第一附属医院为共同通讯单位,四川大学生物治疗全国重点实验室硕士研究生彭沛澜、博士研究生曹蒋军和四川大学华西医院博士后程文婷为共同第一作者,同济大学附属上海市第四人民医院张志奇教授、四川天府锦城实验室主任黄灿华教授和海南医科大学第一附属医院郑少江教授为共同通讯作者。该研究得到国家重点研发项目、国家自然科学基金等项目的资助。
2.郭峻莉/揭伟团队报道靶向干预miR-103a-3p/RND3/STAT3通路治疗糖尿病心肌细胞衰老的研究成果
2025年3月2日,热带转化教育部重点实验室,海南省热带心血管病研究重点实验室,公共卫生学院和第一附属医院郭峻莉教授、揭伟教授在《Aging Cell》在线发表题为“Diabetes Advances Cardiomyocyte Senescence Through Interfering Rnd3 Expression and Function”的研究论文。

本研究系统阐述了miR-103a-3p/RND3/STAT3信号通路在糖尿病诱导心肌衰老中的核心调控机制。从分子机制层面揭示了在糖尿病患者体内miR-103a-3p表达上调,并特异性结合Rnd3 mRNA的3′UTR区抑制RND3蛋白表达,进而减弱RND3对p-STAT3泛素化-蛋白酶体降解途径的调控作用,导致p-STAT3异常激活。持续的p-STAT3信号传导促进衰老相关分泌表型(SASP)的持续表达,最终引发心肌细胞衰老。值得注意的是,通过AAV9递送miR-103a-3p Sponge、过表达RND3或抑制STAT3活性等干预手段,均可显著缓解糖尿病诱导的心肌细胞衰老表型。该研究首次阐明了RND3在糖尿病心肌细胞衰老中的上下游调控网络,为糖尿病相关心肌衰老的防治提供了新的分子靶点和理论依据。
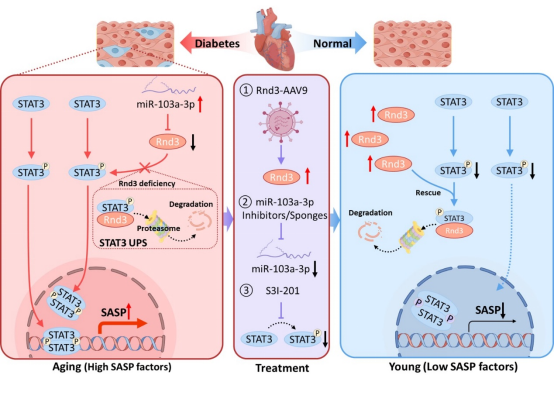
该成果以海南医科大学为第一作者单位,海南医科大学第一临床学院硕士研究生吴林栩、朱星霖和潘珊珊以及博士研究生陈艳为共同第一作者,热带转化教育部重点实验室,海南省热带心血管病研究重点实验室,公共卫生学院和第一附属医院郭峻莉教授和揭伟教授及广东医科大学申志华教授为共同通讯作者。本研究获得国家自然科学基金、海南省重点研发基金和海南省研究生创新研究基金等项目资助。
3. 夏乾峰团队发表关于类鼻疽伯克霍尔德菌胞外囊泡sRNA快速可视化检测的研究成果
3月15日,热带医学院夏乾峰教授团队在国际权威学术刊物《Sensors and Actuators: B. Chemical》报道了题为“An ultrasensitive lateral flow strip assay based on MXene@PtCu nanozymes for visual biosensing of Burkholderia pseudomallei EV-sRNA”的研究成果。

类鼻疽伯克霍尔德菌(B. pseudomallei)是人类和动物类鼻疽病的病原体。类鼻疽病临床表现多样,死亡率高(40%),潜伏期长,给早期诊断带来挑战。目前的检测技术成本高昂、耗时费力,需要复杂的基因组扩增过程、严格的引物设计、抗体特异性验证,并且在感染早期阶段敏感性较低。因此,在感染早期阶段能够轻松地在体液中检测到的新型特异性生物标志物,以及快速、准确、超敏感的诊断策略的研发至关重要。本研究筛选了来自B. pseudomallei胞外囊泡(EVs)中的小RNA(sRNA)BprsO作为新型类鼻疽诊断生物标志物,并利用MXene@PtCu纳米酶和CHA技术实现了双信号放大,最终成功地将核酸浓度检测转化为易于获取的可视化检测信号。该研究为病原菌诊断标志物的筛选提供了全新的视角。未来也可以进一步优化方法,提高其在复杂样本中的稳定性和准确性,并探索其在临床诊断和治疗监测中的实际应用潜力。
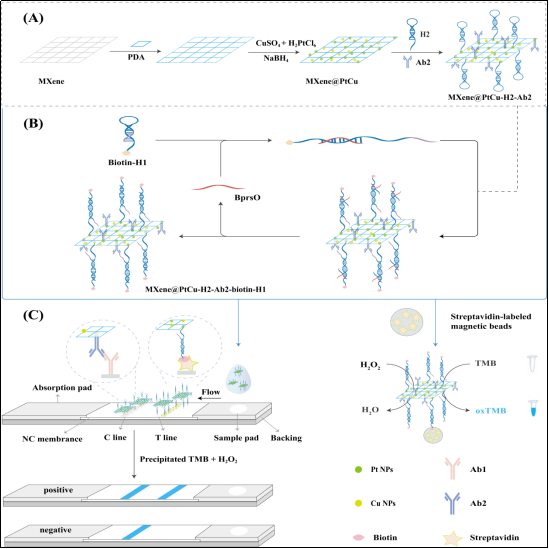
该研究成果以海南医科大学为第一作者单位,热带医学院硕士研究生谭君,教师罗妮妮和张婷为共同第一作者,热带医学院夏乾峰教授、南京大学鞠熀先教授、上海交通大学医学院附属上海儿童医学中心海南分院的刁奇志教授为共同通讯作者。该工作受到国家自然科学基金面上项目、国家重点研发计划和海南省重大科技计划等项目的资助。
4.于法标团队开发新型生物正交 SERS-生物发光探针通过双模态生物成像追踪三阴性乳腺癌的转移
3月16日,急救与创伤教育部重点实验室/急诊创伤学院于法标教授团队在《Acta Biomaterialia》上发表了题为“Bioorthogonal SERS-Bioluminescence Dual-Modal Imaging for Real-Time Tracking of Triple-Negative Breast Cancer Metastasis”的研究成果。

三阴性乳腺癌(TNBC)是一种高度侵袭性的乳腺癌亚型,其特征是缺乏雌激素受体、孕激素受体以及人类表皮生长因子受体2(HER2)的过表达。这种亚型由于其快速进展和早期向重要器官(如肺、肝和脑)转移的倾向而带来了重大挑战。TNBC的转移与不良预后和有限的治疗选择相关,因此迫切需要开发有效的监测策略以实现早期检测和干预。如果能够监测甚至通过药物阻断早期肿瘤转移,患者的预后将得到显著改善。
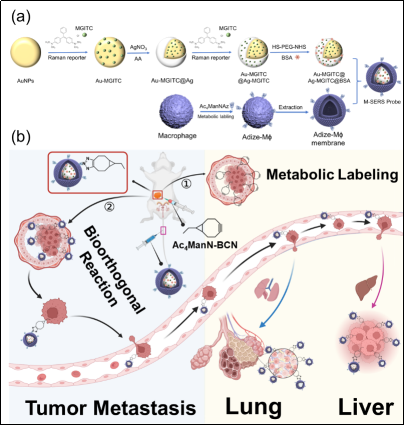
在本研究提出了叠氮基标记的巨噬细胞膜来封装SERS探针,以延长其循环时间并增加其在肿瘤中的有效积累。叠氮基通过糖代谢处理叠氮糖Ac4ManNAz标记在巨噬细胞膜上。荧光素酶标记的肿瘤细胞(4T1-Luc)通过先前瘤内注射的BCN糖Ac4ManNBCN进行天然糖代谢携带BCN基团。Au@Ag核壳纳米粒子固定了双层拉曼报告分子,并与HS-PEG结合后涂覆BSA形成SERS探针,然后用提取的叠氮基标记巨噬细胞膜封装,形成叠氮基标记的MϕM封装SERS探针(M-SERS探针)。通过将巨噬细胞膜转移到SERS探针上,M-SERS探针可以抑制巨噬细胞的吞噬作用,这有助于通过减少不利清除延长其在血液循环中的时间。此外,叠氮基和BCN基团之间的生物正交反应可以显著增强M-SERS探针的锚定效果。SERS和生物发光双模态成像实现了对TNBC器官转移的实时和精确追踪,尤其是对小型转移病灶。该研究成果以海南医科大学为第一作者单位,急诊创伤学院青年教师张伟,硕士研究生王思厶为共同第一作者,于法标教授、王锐教授担任共同通讯作者。该研究受到国家自然科学基金项目和海南省重点研发计划等项目资助。
