
Tumour-derived microparticles obtained through microwave irradiation induce immunogenic cell death in lung adenocarcinoma
通过微波辐射获得的肿瘤来源微粒可诱导肺腺癌细胞发生免疫原性细胞死亡
主讲人:李世伟,2025年6月22日
研究背景:
TMPs 的应用潜力:TMPs 作为细胞外囊泡(EVs)的一种亚型,因具备天然靶向能力与免疫刺激特性,在肿瘤免疫治疗与疫苗开发领域展现出巨大潜力。它含有多种肿瘤相关抗原和 DNA 片段,能够激活树突状细胞(DCs),引发先天免疫反应。
传统制备方法的局限:尽管紫外线(UV)辐射能提高 TMPs 产量,且载药的 UV-TMPs 在临床前和临床研究中能抑制肿瘤生长,但单独使用时杀瘤活性不足。同时,人们对 UV-TMPs 内核酸物质的长期风险存在担忧,这限制了其临床转化。
微波技术的优势:微波(MW)技术在肿瘤消融中应用广泛,具有愈合快、安全且精准定位等优点。基于此,研究人员探索利用微波辅助制备 TMPs(MW-TMPs),期望提升其生物安全性、生产效率及抗肿瘤治疗效果。
研究内容:
该研究介绍了一种利用微波(MW)辅助制备肿瘤微粒(MW-TMPs)的方法,其在肺癌治疗中展现出良好的抗肿瘤效果及药物递送潜力,以下是具体研究内容:
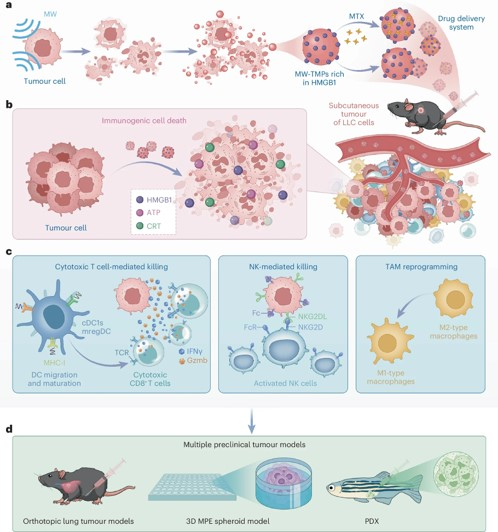
一、MW-TMPs 的制备与特性
制备方法:将肿瘤细胞置于家用微波炉中(700 瓦,20 秒)短暂暴露于短波微波辐射,通过离心策略分离获得 MW-TMPs。
特性优势:
(1)产量与安全性:产量效率高于紫外线诱导的肿瘤微粒(UV-TMPs),且核酸含量较低,降低基因转移风险。
(2)形态与标志物:呈椭圆形,表达微泡标志物膜联蛋白 V 及关键 EV 标志物 CD63、CD9 和 TSG101,保留肿瘤发生特征(如 EGFR、EpCAM 等)。
二、MW-TMPs 的抗肿瘤机制
诱导免疫原性细胞死亡(ICD):
(1)机制:MW-TMPs 富含损伤相关分子模式(DAMP)如 HMGB1,可诱导肿瘤细胞中 ICD 标志物(HMGB1、ATP、钙网蛋白 CRT)表达上调,触发促炎级联反应,增强适应性免疫反应。
(2)证据:HMGB1 抑制剂可抑制上述效应,且 MW-TMPs 预处理的肿瘤细胞能促进 DC 成熟及 T 细胞活化。
重塑免疫微环境:
(1)激活 DC 与巨噬细胞:增加肿瘤内常规树突状细胞 1 型(cDC1)和免疫调节性 DC(mregDC)数量,增强 mregDC 的 MHC I 类抗原呈递能力;促进巨噬细胞向抗肿瘤 M1 型极化,减少免疫抑制性 M2 型。
(2)扩增细胞毒性免疫细胞:促进 CD8+ T 细胞中效应 / 记忆亚群(CD8_c3)扩增,增加其 Gzmb/IFNγ 分泌;选择性扩增细胞毒性 NK 细胞亚群(NK_FCGR3),增强其 IFNγ 产生。
三、MW-TMPs 的抗肿瘤效果
体内外模型验证:
(1)肺癌模型:在皮下和原位肺癌模型中,MW-TMPs 显著抑制肿瘤生长,且无全身毒性;在斑马鱼患者来源肿瘤异种移植(PDX)模型中亦证实其抗肿瘤效果。
(2)恶性胸腔积液(MPE)模型:MW-TMPs 可被 MPE 中的肿瘤细胞优先摄取,诱导 ICD 并促进 DC 成熟及巨噬细胞重极化,抑制 3D 多细胞球体生长。
联合治疗潜力:
(1) 与抗 PD-L1 疗法协同:MW-TMPs 联合抗 PD-L1 抗体可增强抗肿瘤反应,效果优于单药治疗。
(2)药物递送功能:负载甲氨蝶呤(MTX)的 MW-TMPs(MW-TMPs-MTX)具有良好的药物封装与持续释放特性,体外抑制肿瘤细胞增殖,体内协同增强抗肿瘤效果。
总结与展望:
本研究开发了一种利用微波(MW)辅助制备肿瘤来源微粒(MW-TMPs)的方法,其制备过程简单、高效且安全性优于传统紫外线(UV)诱导的 TMPs(UV-TMPs)。MW-TMPs 可通过释放高迁移率族蛋白 B1(HMGB1)诱导肿瘤细胞发生免疫原性细胞死亡(ICD),并重塑肿瘤免疫微环境,激活自然杀伤细胞(NK 细胞)和 T 细胞对肿瘤的双重攻击。在肺癌模型中,MW-TMPs 不仅能显著抑制肿瘤生长,还可作为甲氨蝶呤(MTX)的靶向递送载体,与抗 PD-L1 免疫疗法协同增强疗效。其作用机制包括:通过 HMGB1 转运诱导 ICD、促进树突状细胞(DC)成熟及巨噬细胞向抗肿瘤表型极化、扩增细胞毒性 T 细胞和 NK 细胞亚群。此外,MW-TMPs 在恶性胸腔积液(MPE)模型及斑马鱼 PDX 模型中均验证了抗肿瘤效果,为临床转化提供了依据。

