活性氧和氮物种(RONS)介导氧化还原信号传导和细胞稳态功能,但RONS失衡也会导致氧化损伤,并促进衰老、急性脑损伤和神经退行性疾病的发生。在正常生理条件下,RONS是重要的化学调节剂,为正常的代谢过程(氧化稳态)提供高效、必要的信号传导和电子传递途径。然而,当内源性细胞抗氧化途径不堪重负或达到饱和状态(即发生氧化应激)时,原本寿命短、浓度低的RONS会与细胞环境引发一系列自由基链反应。大量证据也支持过氧自由基和过氧亚硝基阴离子在脑缺血后损伤中的重要性。缺血(和/或缺血后再灌注)会通过与细胞膜的过氧自由基或过氧亚硝基阴离子链反应显著增加RONS。由此产生的链反应会导致缺血性脑损伤,表现为水肿、梗死和神经元病变。也有大量证据表明,氧化应激在阿尔茨海默病(AD)的病理和进展中发挥作用。RONS是急性脑损伤和神经退行性病变中需要监测的重要病理介质,也可能是这些疾病中抗氧化剂和自由基清除剂药物开发的诱人靶点。然而,在体内测量RONS具有挑战性,过去评估抗氧化剂疗效的临床试验缺乏证据表明假定治疗能够减少大脑中的RONS,从而使阴性结果的分析变得复杂。因此,无法阐明RONS的最佳治疗窗口阻碍了客观评估治疗效果、监测疾病进展和预测症状。因此,能够量化中枢神经系统(CNS)衍生的RONS的成像方法或实验室生物标志物将有助于评估疾病进展和设计抗氧化剂的临床试验。
目前对活体中RONS的评估主要局限于对氧化损伤的体外测量。体内RONS检测方面的进展包括正电子发射断层成像(PET)、电子顺磁共振和超极化[13C]磁共振成像(MRI)。在这些方法中,PET具有卓越的空间分辨率,非常适合临床应用,这一点从许多已用于临床的PET探针中得到了证实,这些探针用于评估脑灌注、氧和葡萄糖代谢、神经炎症以及AD患者大脑中淀粉样蛋白或tau蛋白的积聚。为此,已开发出几种放射性药物作为RONS的潜在PET成像探针,但其应用受到生物不稳定性、血脑屏障(BBB)通透性差或RONS反应谱狭窄的限制。
近日,美国弗吉尼亚大学放射学和医学影像学系Kiel D. Neumann教授率领其团队报道了一种PET探针的合成和表征——[18F]FEDV,用于氧化应激的体内定量。该探针来源于抗氧化剂依达拉奉,可通过血脑屏障扩散,并在人血浆中稳定。在小鼠中,使用[18F]FEDV 允许在纹状体内注射硝普钠、光血栓中风以及患有tau 蛋白病的大脑中检测到 RONS。[18F]FEDV-PET结合动态成像与参数映射技术,对RONS的高敏感性使其能够检测到氧化应激的增加。[18F]FEDV-PET可用于在体内纵向量化RONS,并评估抗氧化剂临床研究的结果。
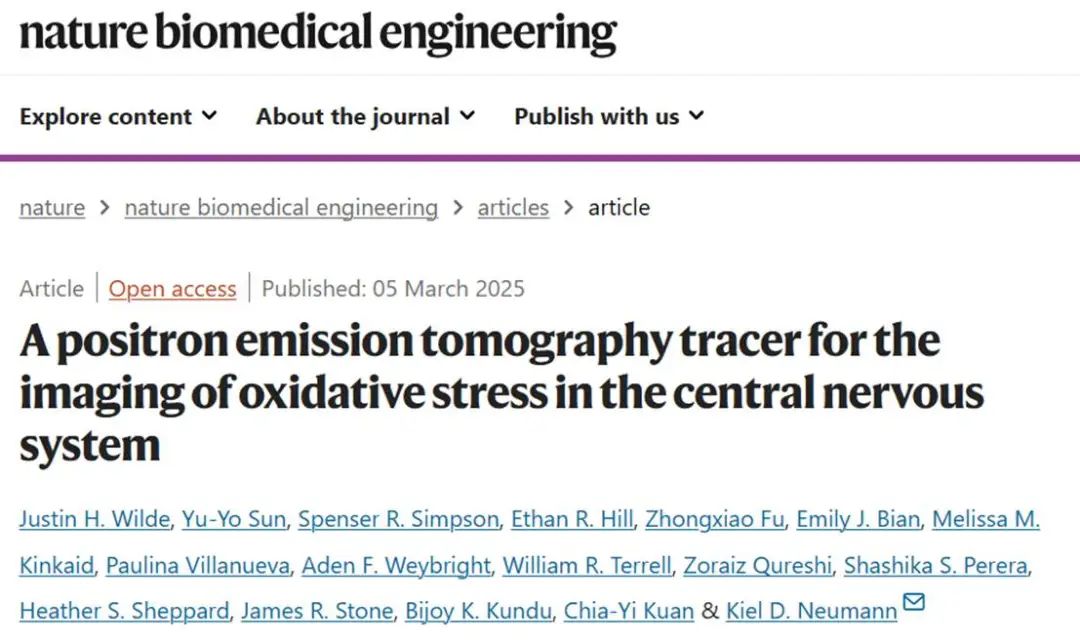
[18F]FEDV的合成和体外表征:
依达拉奉被开发为过氧化自由基(ROO•)清除剂,过氧化自由基是氧化损伤的强大诱导剂,它还能与包括脂质和水相中的羟基(OH•)、超氧化物和过氧亚硝基阴离子(ONOO–)在内的广泛RONS反应。依达拉奉具有适当的亲脂性,可被动扩散穿过血脑屏障和细胞膜。依达拉奉和过氧化自由基之间的细胞内反应会产生一种不稳定的中间体,该中间体迅速转化为2-氧代-3-(苯肼基)丁酸(OPB),OPB不能自由穿过细胞膜。如果OPB可以携带检测信号,那么依达拉奉的这些特性将完美切合对于RONS检测探针的需求。
因此,作者团队假设,与依达拉奉类似物——[18F]依达拉奉([18F]FEDV)也可能穿过血脑屏障和细胞膜,并产生PET信号,这些信号在体内指示CNS氧化应激。探针[18F]FEDV是通过两步三阶段的放射化学反应合成的。首先,从4-氟苯肼合成了前体(1),即叔丁氧羰基保护的叠氮三甲基铵三氟甲磺酸盐。在下一步用[18F]氟化物对(1)进行亲核芳香取代反应,生成(2)。该反应通过固相萃取进行简短纯化后,再用乙酸洗脱法将(2)转移到事先装有锌粉的新反应器瓶中。在反应器瓶中加入乙酰乙酸乙酯和盐酸,加热20分钟后,通过同时脱保护和缩合生成最终产物[18F]FEDV。经过HPLC纯化和60分钟内的重新配制后,[18F]FEDV以12%±1%的活性产率合成。这种直接的放射合成方法生产的[18F]FEDV具有>99%的放射化学纯度。
接下来,研究[19F]FEDV与主要氧化剂在体外的反应谱,并测试了[19F]FEDV是否拥有与依达拉奉一样的脂溶性和水溶性过氧化自由基反应。当[19F]FEDV(50μM)与ClO–、过氧亚硝基阴离子、OH•、NO•、叔丁氧基(t-BuO•)在水性或脂质溶液中一起孵育时,[19F]FEDV在5分钟内完全转化为[19F]F-OPB。相比之下,[19F]FEDV对H2O2和叔丁基过氧化氢(t-BuOOH)的反应性非常低,这也与依达拉奉相似。这些结果表明,[19F]FEDV能与包括脂相和水相过氧化自由基在内的广泛RONS发生强烈反应。当N2a和EMT6细胞与[18F]FEDV一起孵育,并在TBHP或多柔比星处理后0.5-3小时进行评估时,细胞相关放射性在处理后2小时内迅速增加。在0.1-10mM非放射性依达拉奉存在的情况下,TBHP和多柔比星处理后的[18F]FEDV的细胞摄取被阻断,这支持了细胞中[18F]FEDV相关放射性的RONS特异性。比较了[18F]FEDV在5%乙醇/生理盐水和人血浆中的稳定性。在5%乙醇/生理盐水中,[18F]FEDV表现出卓越的稳定性,8小时后>99%的[18F]FEDV保持不变。该探针在人血浆中3小时后也保持>90%的完整性,表明[18F]FEDV具有高稳定性和最小的辐解。综上所述,这些结果表明[18F]FEDV对RONS具有广泛的反应谱,并且具有体内成像所需的良好稳定性。
图:[18F]FEDV的合成和体外表征
SNP 诱导的体内氧化应激成像:
为了测试[18F]FEDV作为体内RONS的PET探针的潜力,首先通过向小鼠纹状体内SNP诱导氧化应激。尽管SNP是一种一氧化氮供体,但它还会产生超氧化物和其他RONS,从而导致过氧亚硝基阴离子和脂质过氧化物的形成。在使用二氢乙啶(DHE)作为RONS示踪剂的初步实验中,与注射生理盐水的小鼠相比,注射SNP的小鼠在死后荧光显微镜图像上显示出更强烈的氧化二氢乙啶(oxHET)标记。同样,注射SNP的小鼠大脑在患侧显示出强烈的[18F]FEDV-PET信号。以纹状体为中心的时间-活性曲线显示,注射SNP的小鼠的平均[18F]FEDV-PET信号显著强于注射生理盐水的小鼠。为了模拟PET扫描的临床工作流程,在静脉注射[18F]FEDV后45–60分钟时,计算出注射SNP的小鼠的最大标准摄取值(SUV)显著高于注射生理盐水的小鼠。为了确认[18F]FEDV在体内对RONS的特异性,进行了一项阻断研究,其中注射SNP的小鼠在注射[18F]FEDV前5分钟通过静脉注射15 mg/kg依达拉奉进行预处理。预防性依达拉奉治疗显著降低了SNP小鼠的[18F]FEDV-PET信号。这些结果进一步表明,[18F]FEDV在体内对RONS具有特异性。
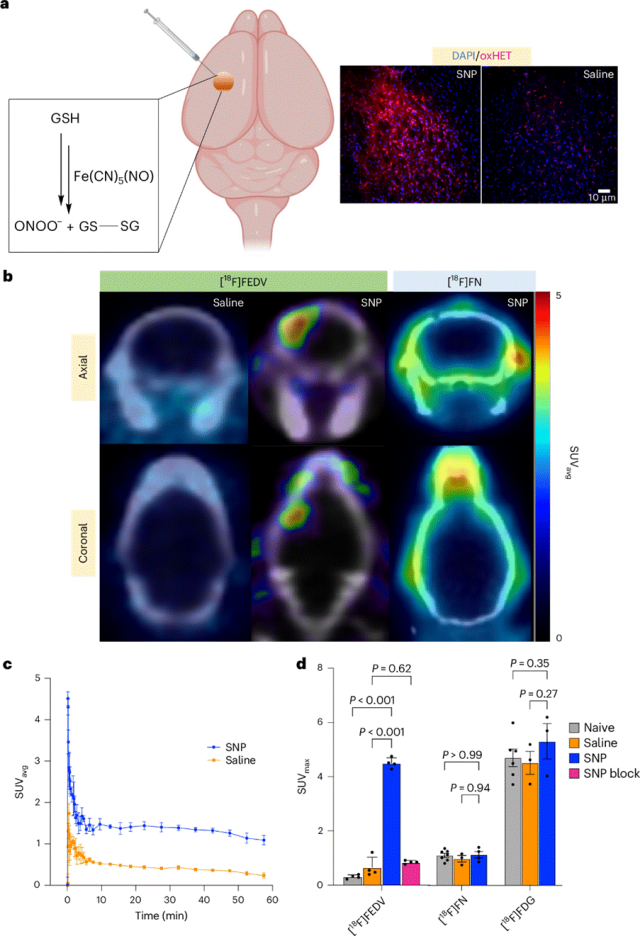
图:对SNP诱导的体内氧化应激进行成像
[18F]FEDV-PET的应用:
接下来在小鼠中诱导单侧光血栓(PT)卒中,以测试[18F]FEDV是否能在临床相关模型中检测体内的RONS。小鼠经眶后注射玫瑰红染料,在大脑中动脉(MCA)近端分支处暴露于543纳米激光照射,然后在4小时或24小时后通过[18F]FEDV-PET进行成像。在PT后4小时,在假手术处理或卒中损伤小鼠的大脑中未检测到PET信号的显著差异,但在PT后24小时,卒中损伤小鼠患侧大脑皮层的[18F]FEDV-PET信号显著增加。患侧大脑皮层聚焦的[18F]FEDV时间-活性曲线显示,在PT后24小时,[18F]FEDV衍生的PET信号持续稳定增加。在[18F]FEDV注射后45–60分钟的静态PET成像显示,PT后24小时的平均SUV高于PT后4小时。值得注意的是,卒中损伤小鼠患侧大脑皮层在PT后24小时的脂质过氧化标志物丙二醛(MDA)含量高于对侧皮层,但在PT后4小时则无此差异。这些结果,结合SUV分析和离体脑组织的γ计数,表明在PT后24小时,在没有增加先天性免疫激活([18F]FN阴性)的情况下发生了氧化应激诱导。
缺血性脑卒中会破坏血脑屏障(BBB)。试图确认观察到的[18F]FEDV-PET信号增强不仅仅是由于PT后24小时BBB渗漏所导致的。在假手术处理的小鼠和PT后24小时的小鼠中注射了[18F]FEDV或[68Ga]EDTA(一种在BBB受损时会积聚在中枢神经系统的非特异性放射性药物)并比较了它们的水平。再次发现,PT后24小时小鼠大脑的患侧皮层[18F]FEDV信号大幅增加,且两侧大脑半球的基线水平均高于假手术处理的小鼠大脑。相比之下,与对侧皮层或假手术处理的大脑相比,PT后24小时小鼠大脑的患侧皮层中[68Ga]EDTA相关放射性仅略有增加。综上所述,这些结果表明,PT后24小时[18F]FEDV-PET信号增强并非仅由渗出作用所导致。
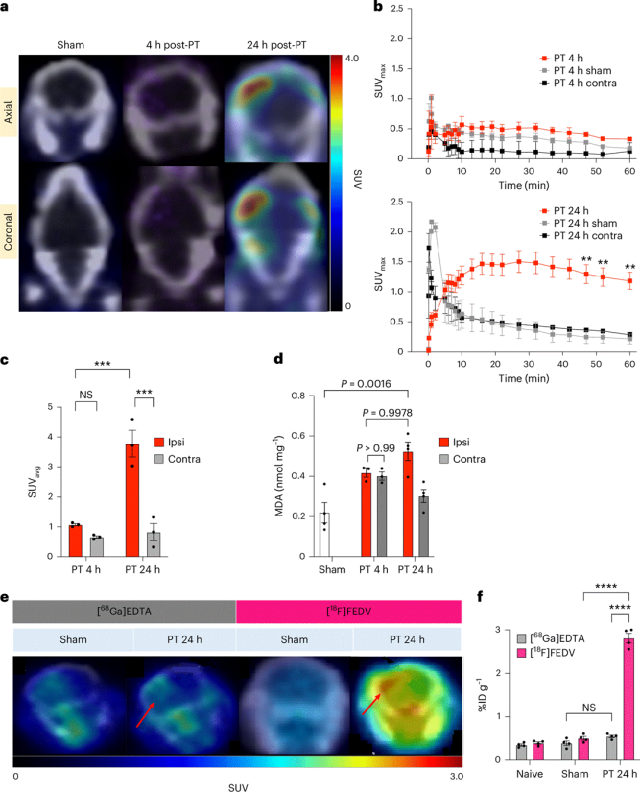
图:中风小鼠模型中的体内氧化应激成像
[18F]FEDV-PET 氧化应激动态成像:
MDA检测是RONS的间接测定方法,因为它量化的是氧化损伤,而不是RONS的特异性反应。使用死后大脑中oxHET的荧光来测试PT卒中模型中氧化应激发生的时间。该实验显示,在PT后4小时和24小时,患侧大脑皮层的oxHET信号显著增加,表明氧化应激迅速发生。同样,[18F]FEDV-PET成像后的离体脑放射自显影也显示,在PT后4小时和24小时,患侧皮层中放射性持续存在。这些结果表明,尽管静态SUV分析在临床工作流程中很常见,但可能会低估小型啮齿类动物大脑对[18F]FEDV的摄取,因为它无法区分来自血液和组织的PET信号。
测试参数映射的[18F]FEDV-PET动态成像是否能提高探针检测PT后小鼠大脑中RONS的敏感性。小鼠经静脉注射[18F]FEDV,并在PT后4小时或24小时通过PET进行60分钟的动态成像。PET扫描完成后,小鼠立即进行T2加权MRI成像,以确定缺血区域,据此勾画VOI以量化PT后或假手术处理动物患侧和对侧半球之间组织中[18F]FEDV摄取率(Ki)。该分析显示,在PT后4小时和24小时,患侧皮层中[18F]FEDV摄取增加,且与T2加权MRI信号共定位。因此,与对侧半球或假手术处理小鼠大脑两侧半球内的VOI相比,参数映射显示在PT后4小时和24小时的VOI内Ki显著更高。这些结果表明,参数映射的动态PET成像显著提高了[18F]FEDV检测体内RONS的敏感性。
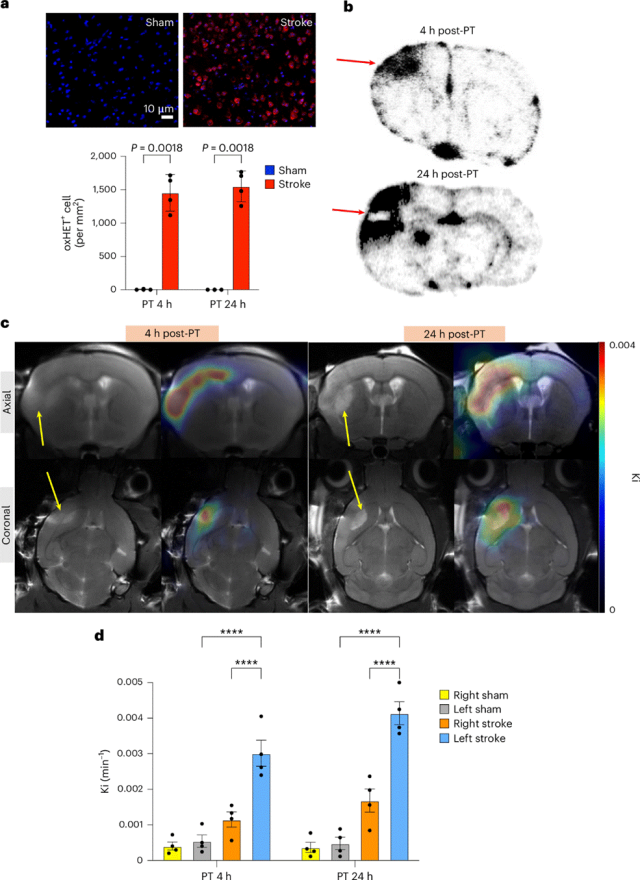
图:具有参数映射的[18F]FEDV-PET动态成像显着提高了探针对RONS的敏感性
[18F]FEDV-PET成像在PS19 tau蛋白病小鼠中的应用:
最后,利用[18F]FEDV-PET比较了杂合子PS19小鼠与野生型(WT)小鼠的大脑,因为氧化应激已被认为是AD的发病机制之一。PS19小鼠表达人类P301S突变型tau蛋白,从10月龄起,其大脑皮层线粒体组分中蛋白质羰基化现象明显,但迄今为止,尚未有报道对PS19小鼠体内活性氧氮物种(RONS)进行量化的活体成像研究。与同龄雄性WT小鼠相比,[18F]FEDV-PET/MRI成像显示12月龄雄性杂合子PS19小鼠的PET信号显著增加。SUV分析显示,包括海马体、纹状体、丘脑、下丘脑、杏仁核、中脑、小脑和脑干在内的大多数脑区域对[18F]FEDV的摄取量显著增加。在[18F]FEDV-PET/MRI成像后,进行oxHET标记以验证体外的RONS-PET信号。在死后荧光显微镜下观察,与WT小鼠相比,PS19小鼠的海马区中oxHET细胞显著增加。同样,PS19小鼠的海马区磷酸化tau蛋白染色水平高于WT小鼠。这些结果表明,通过临床标准的静态PET进行的[18F]FEDV成像足以检测到12月龄PS19 tau蛋白病患者小鼠大脑中更高的氧化应激水平。
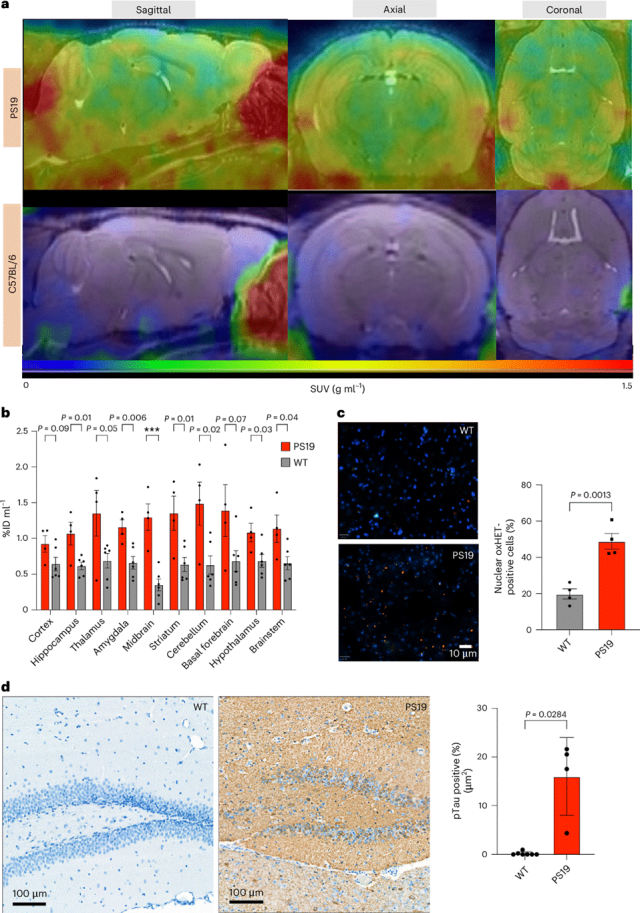
图:[18F]FEDV-PET成像可检测到P301S小鼠大脑中RONS的增加
小结:
神经退行性疾病的病理过程在症状出现前几年就已开始,且进展速度因人而异。例如,AD的痴呆阶段之前会经历临床前期(认知行为正常,但生化指标发生变化)和前驱期(轻度认知障碍)。因此,能够检测中枢神经系统(CNS)病变起始的分子和成像生物标志物对于评估疾病进展和选择早期干预的患者具有重要价值。淀粉样蛋白PET和tau-PET扫描是AD最常用的两种成像生物标志物,因为它们可以直接评估大脑中淀粉样斑块和tau纤维的积聚和区域扩散。然而,AD相关和神经退行性疾病成像生物标志物的一个明显缺陷是无法在体内检测CNS的氧化应激。越来越多的证据表明,过度的氧化应激(超出正常应激范围)会加剧急性脑损伤和慢性神经退行性病变,如AD和ADRD。AD/ADRD中的氧化应激源于线粒体氧化磷酸化功能障碍、抗氧化剂减少以及Aβ或tau低聚物诱导的神经毒性或小胶质细胞分泌的RONS,这些都会加速衰老或引发神经退行性病变。与此观点一致的是,在AD小鼠模型中,细胞抗氧化反应的主要调节因子Nrf2的基因缺失会加剧认知障碍和Aβ沉积。因此,氧化应激可能是AD/ADRD的一个有前景的治疗靶点,但在临床研究环境中纵向量化氧化应激的最终目标受到了一些实际挑战的限制。
首先,由于RONS性质不稳定且半衰期短,直接在体内测量RONS具有挑战性。目前的方法依赖于对死后大脑中氧化损伤的间接测量,或在血液或尿液中测量替代生物标志物(例如8-OHdG和异前列腺素8),这些可能并不代表活体患者大脑中的微环境。其次,由于没有临床成像工具可以在体内测量大脑中的氧化应激,客观评估抗氧化剂疗效的能力受到很大限制。例如,之前一项使用维生素E(仅作用于脂质相的抗氧化剂)的临床试验在预防轻度认知障碍患者发展为痴呆方面显示出阴性结果。然而,目前尚不清楚RONS是否是AD的一个不佳的治疗靶点,维生素E是否是一种仅限于脂质相RONS反应性的低效抗氧化剂,或者给予的维生素E剂量是否只是不足以减少大脑中的RONS。
鉴于这些未满足的临床需求,作者团队开发了一种基于临床上广泛使用的抗氧化剂依达拉奉的体内PET成像探针,用于检测CNS中的RONS水平。将氟-18添加到依达拉奉中后,它仍然可以与多种RONS(包括脂溶性和水溶性过氧自由基和过氧亚硝基阴离子)发生广泛反应。重要的是,[18F]FEDV能够轻易穿过血脑屏障(BBB)和细胞膜,这是成功进行RONS-PET成像的先决条件。尽管18F标记的放射性药物经常受到辐射分解的困扰,这会阻碍PET成像探针的开发,[18F]FEDV在溶液中仍具有很高的稳定性。最后,体外量化了[18F]FEDV在小鼠器官中的生物分布,并表明[18F]FEDV的分布和清除与先前在人类中表征的依达拉奉数据一致。因此,[18F]FEDV具有研究RONS参与疾病病理的多种疾病所需的化学反应性和生物相容性。[18F]FEDV可量化由SNP或卒中损伤以及AD的PS19小鼠模型中引起的氧化应激。动态成像进一步提高了[18F]FEDV-PET在体内检测氧化应激的敏感性。[18F]FEDV的可用性将有助于解决重要的临床聚焦研究问题,如确定减轻氧化应激的治疗窗口、评估抗氧化治疗的目标参与情况以及确定最适合抗氧化治疗的患者。[18F]FEDV的可用性将增强对AD/ADRD中氧化应激与其他病理过程之间关系的理解,或在存在或不存在大脑中的淀粉样蛋白PET信号的情况下区分正常衰老与AD前驱期。[18F]FEDV易于生产、体内敏感,且与美国食品药品监督管理局(FDA)批准的药物依达拉奉的化学结构几乎相同,这为其在临床研究中的进一步发展提供了依据,以阐明以氧化应激为根源的疾病病因。
参考文献:
Justin H Wilde, Yu-Yo Sun, Spenser R Simpson, et al. A positron emission tomography tracer for the imaging of oxidative stress in the central nervous system. Nat Biomed Eng. 2025 Mar 5.
https://www.nature.com/articles/s41551-025-01362-3

