共聚焦显微镜在内质网-线粒体钙转运研究中的应用
案例分享(一)
猪繁殖与呼吸综合征是由PRRSV(Porcine reproductive and respiratory syndrome virus, PRRSV)引起猪的一种以繁殖障碍和呼吸道疾病为特征的高度传染性疾病。由于没有特效治疗药物和有效的疫苗防治,迄今该疾病仍未取得实质性控制。解析PRRSV增殖的分子机制对于安全高效的新型疫苗设计和抗病毒药物研发具有重要的科学意义。
本研究旨在探讨细胞细胞器在猪生殖和呼吸综合征病毒(PRRSV)复制中的作用。作者揭示了一种新的PRRSV复制机制,即病毒通过PRRSV GP5、IP3R和VDAC1的相互作用操纵线粒体-内质网接触,诱导Ca2+过度流出到线粒体,导致线粒体功能障碍和mROS的产生。增加的mROS激活自噬,抑制NLRP3炎症小体的激活,从而促进PRRSV复制。
为了研究细胞器在PRRSV复制中的作用,研究人员检测了PRRSV感染后不同细胞器的形态。对GM130(Golgi)、LAMP1(溶酶体)、Tom20(线粒体)和calnexin(ER)的特异性抗体进行免疫荧光分析。随着感染时间的增加,线粒体出现碎片化和聚集,内质网出现凝结(图1A-E)。研究人员进一步分析二者之间的关系,共聚焦结果显示calnexin和Tom20的荧光信号被覆盖,提示PRRSV感染诱导了内质网-线粒体接触(图1F-G)。这些结果表明,PRRSV感染同时改变了线粒体和内质网的形态,并诱导二者接触。
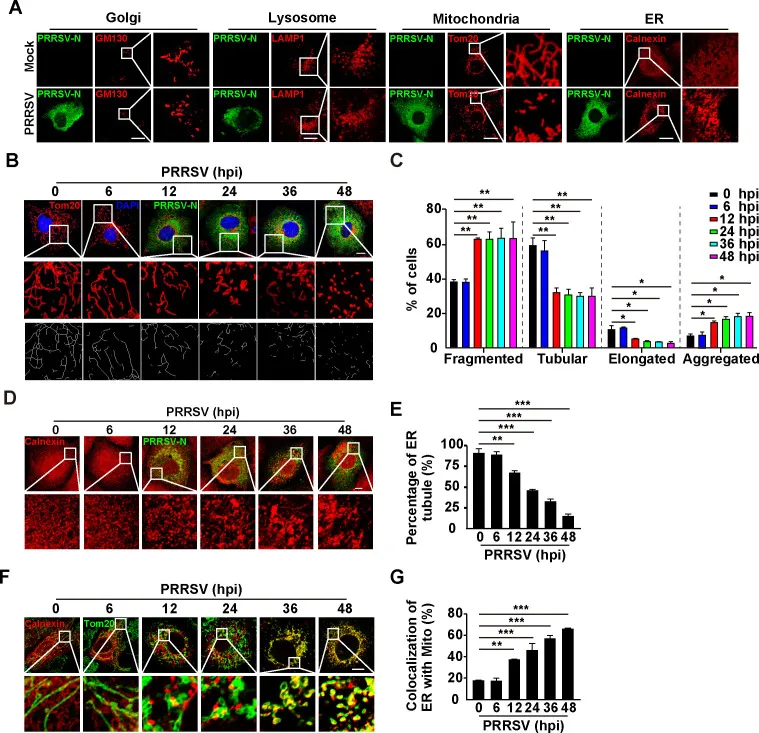
图1 PRRSV感染诱导线粒体和内质网以及ER-线粒体接触的形态学改变。将(A) MARC-145细胞模拟感染或用PRRSV(MOI = 1)感染24 h。(B) MARC-145细胞0-48h(C)(B)中碎片、管状、细长和聚集的定量(n = 30)(D) MARC-145细胞0-48h。(E)(D)中ER小管百分比的定量(n = 30)(F)用PRRSV(MOI = 1)感染MARC-145细胞0-48h(G)对(F)中ER与线粒体共定位的定量分析(n = 30)。
为了探索PRRSV感染如何诱导内质网-线粒体接触,研究人员在MARC-145细胞中过表达PRRSV编码的开放阅读框(ORFs),识别参与线粒体形态改变的蛋白。如图2A-E所示NSP2只能改变线粒体形态而GP5可以同时改变线粒体和内质网的形态。进一步共定位分析发现GP5促进了内质网与线粒体接触(图2F-G)。
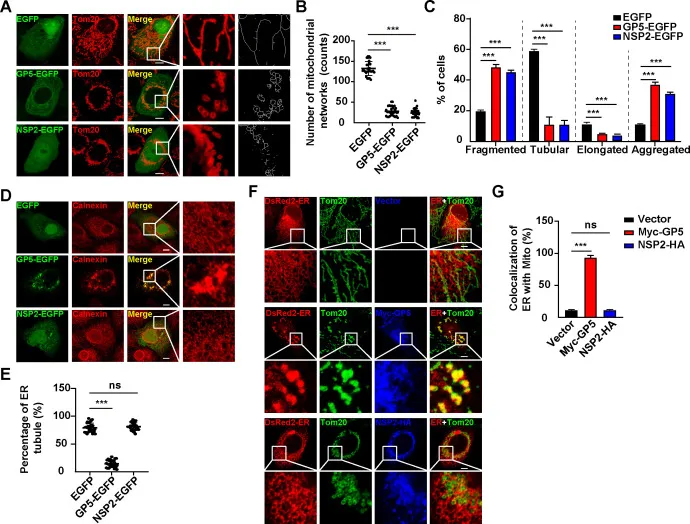
图2 PRRSV GP5负责内质网-线粒体的接触。用EGFP、GP5-EGFP或NSP2-EGFP质粒转染(A) MARC-145细胞24 h。采用免疫荧光法检测线粒体(Tom20)的形态。(B)从(A)中获得的线粒体网络数量的定量分析(n = 30).(C)(A)中碎片、管状、细长和聚集的定量(n = 30).(D) 用EGFP、GP5-EGFP或NSP2-EGFP质粒转染MARC-145细胞24 h。采用免疫荧光分析法检测ER(calnexin)的形态。比例尺:10µm。(E)定量分析(D)中ER小管的百分比(n = 30)(F) MARC-145细胞与pDsRed2-ER和载体Myc-GP5或NSP2-HA共转染MARC-24h。(G)对(F)中ER与线粒体共定位的定量分析(n = 30)。
内质网和线粒体在Ca2+稳态中起着关键作用。研究人员通过RNA干扰法筛选出GP5促进IP3R通道介导的内质网Ca2+外排到线粒体。免疫荧光分析显示,与对照组细胞相比,GP5-EGFP和IP3R之间的共定位增加(图3)。以上结果表明GP5通过与IP3R相互作用介导内质网 Ca2+外排进入线粒体。
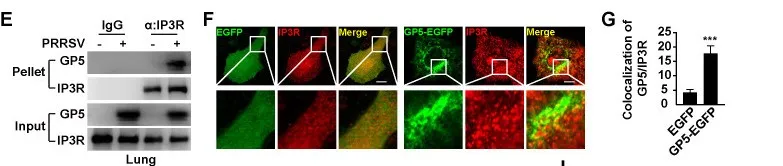
图3 (E)在模拟感染或PRRSV感染的猪肺样本中,通过Co-IP分析来分析GP5与IP3R的相互作用。(F)转染了EGFP-C1和GP5-EGFP的MARC-145细胞,用抗IP3R抗体的免疫染色进行评估(红色)。(G)对(F)中GP5-EGFP与IP3R共定位的定量分析。
电压依赖性阴离子通道(VDAC)是一种位于线粒体外膜的蛋白质,在Ca2+进入线粒体中起着关键作用。共聚焦结果发现无论是PRRSV感染还是GP5-EGFP的表达都能诱导VDAC1结构的聚集,并且该结构与GP5和Tom20共定位(图4H-I)。为了证实IP3R/GP5/VDAC1复合物形成,研究人员进行了接近连接实验(PLA)。与对照组相比,在PRRSV感染过程中,GP5敲低的细胞显示出的VDAC1-IP3R红点数量减少(图4P)。在表达GP5-EGFP的细胞中检测到红点增加(图4Q)。以上结果表明,PRRSV GP5与IP3R和VDAC1相互作用,诱导Ca2+从内质网流出到线粒体。
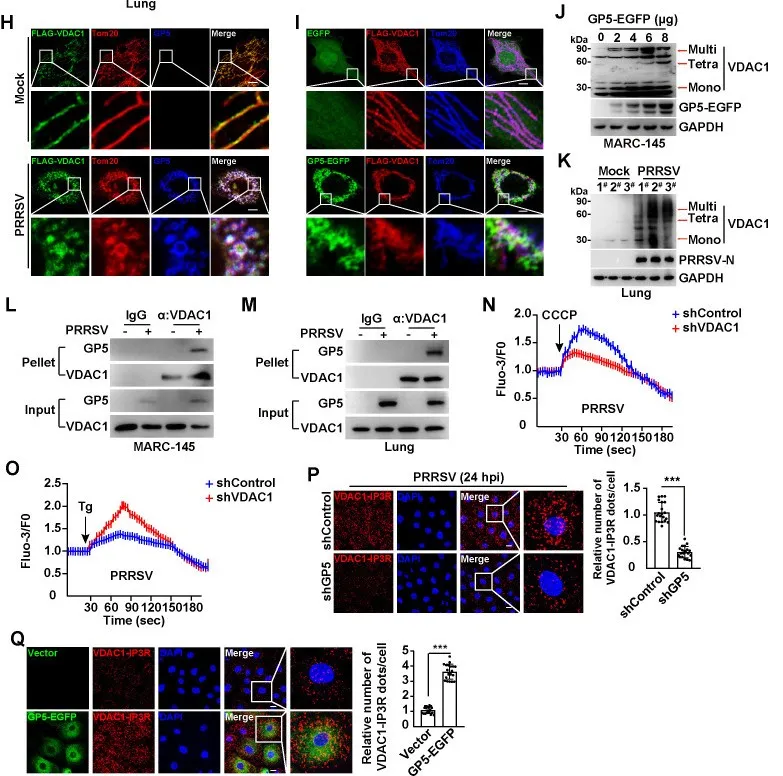
图4 PRRSV GP5与IP3R和VDAC1相互作用(H)用FLAG-VDAC1转染MARC-145细胞24 (H)通过免疫荧光分析检测FLAG-VDAC1、GP5和线粒体(Tom20)的共定位。(I)将FLAG-VDAC1和EGFP或GP5-EGFP质粒共转染MARC-145细胞24 h。通过免疫荧光分析检测FLAG-VDAC1、GP5-EGFP和Tom20的共定位。(J)采用免疫印迹法分析VDAC1寡聚物和GP5-EGFP。(K)通过免疫印迹分析分析模拟感染或PRRSV感染的猪肺样本中的VDAC1低聚物。(L)通过Co-IP分析GP5与VDAC1的相互作用。(M)在模拟感染或PRRSV感染的猪肺样本中,通过Co-IP分析来分析GP5与VDAC1的相互作用。(N)用PRRSV(MOI = 1)感染sh对照组和shVDAC1 MARC-145细胞24 h后,然后用CCCP(10µM)处理,释放线粒体Ca2+。(P)用PRRSV(MOI = 1)感染sh对照组和shGP5 MARC-145细胞24 h。采用PLA法分析VDAC1与IP3R的相互作用(左图)。右侧显示了每个细胞中VDAC1/IP3R点的相对数量的定量分析。(Q)用载体或GP5-EGFP质粒转染MARC-145细胞24 h。采用PLA法分析VDAC1与IP3R的相互作用(左图)。右侧显示了每个细胞中VDAC1/IP3R点的相对数量的定量分析。
案例分享(二)
乳腺癌是女性最常见的恶性肿瘤之一,约占所有女性新发癌症病例的30%,死亡率极高。因此,更好地了解乳腺癌的发病机制对于制定有效的治疗策略至关重要。线粒体的形态和功能被认为与基质硬化驱动的肿瘤进展密切相关,但人们对细胞外基质(ECM)刚度如何影响线粒体动力学和线粒体吞噬仍知之甚少。本文作者揭示了一种新的机制,即ER-MITO钙转运通过Drp1(动力蛋白相关蛋白1)易位响应软底物,调节线粒体动力学和线粒体吞噬。这些发现为ECM硬度作为抗肿瘤治疗的潜在靶点提供了有价值的见解。
在本研究中,研究人员使用不同刚度的PAA凝胶基底来模拟乳腺癌的不同进展阶段,玻璃基团作为对照。利用MitoTracker Red探针对细胞内线粒体进行染色,以评估基质刚度对线粒体形态的影响,结果显示软基质中的线粒体碎裂增加(图5A-B)。为了验证该裂变是否与Drp1相关,研究人员进行了共定位实验,结果显示软底物诱导更多的细胞在线粒体上招募内源性Drp1,促进线粒体碎裂(图5C)。
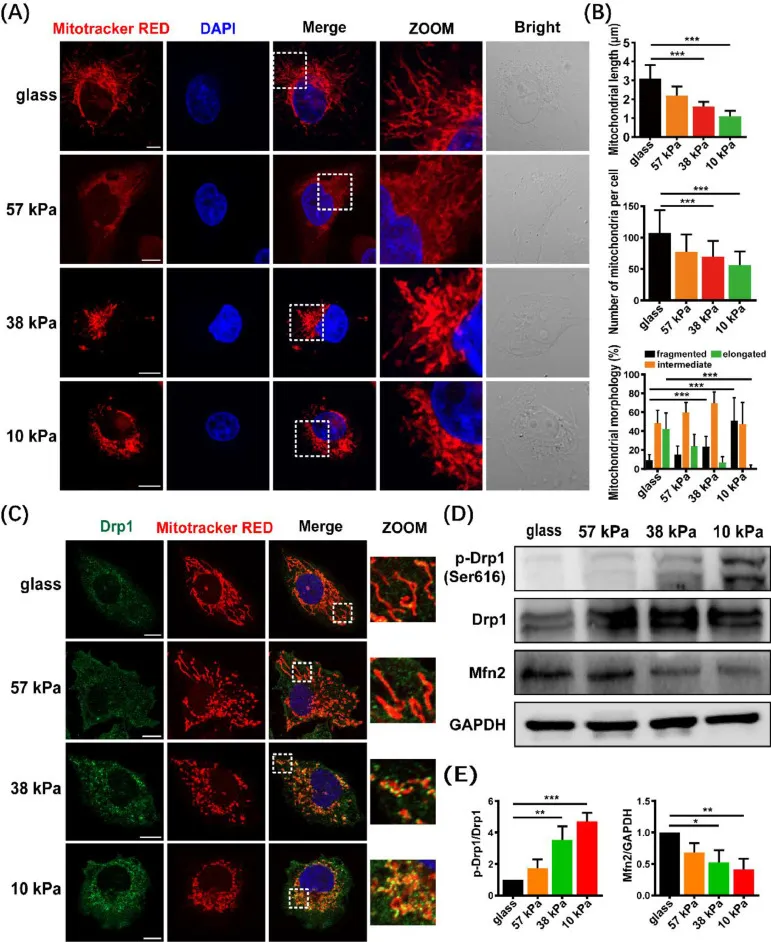
图5 软底物诱导MDA-MB-231细胞线粒体分裂。(A)MDA-MB-231细胞线粒体形态的代表性显微照片。线粒体用线粒体追踪器红色(红色)染色,细胞核用DAPI(蓝色)观察。(B)柱状图显示了线粒体平均长度(顶部)、线粒体数量(中间)和线粒体分为碎片、中间和细长形状的百分比的量化。(C)用抗drp1抗体(绿色)、丝裂追踪器红色(红色)和DAPI(蓝色)染色的细胞的代表性图像(D)线粒体裂变和融合蛋白(Drp1、磷酸化的Drp1-s1616和Mfn2)的免疫印迹分析。(E)蛋白表达的定量分析(n = 3)。
接下来研究人员研究了基质刚度对线粒体吞噬的影响。在不同硬度的基底上培养MDA-MB-231细胞,其共聚焦图像显示于玻璃基团上的低表达相比,LC3(细胞自噬标记物)在软底物上高表达并呈点状分布(图6A)。Parkin(线粒体吞噬的经典途径)与线粒体明显的共定位(图6B)表明软底物促进了MDA-MB-231细胞的线粒体吞噬。
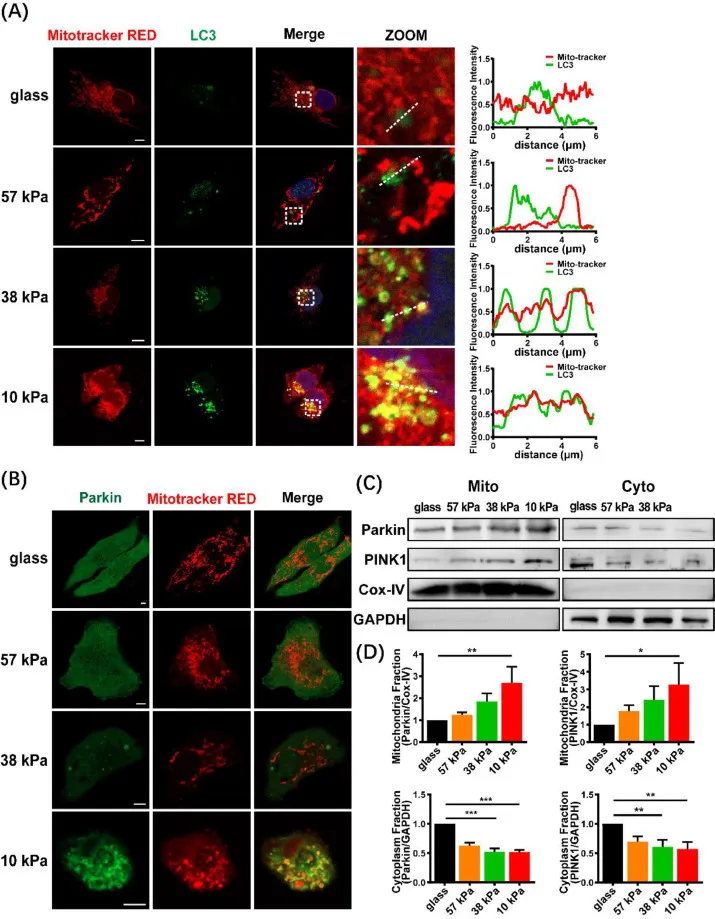
图6 软底物促进了MDA-MB-231细胞中的线粒体吞噬。(A)在不同硬度的基底上培养的MDA-MB-231细胞的代表性共聚焦图像(左)。细胞用抗lc3抗体(绿色)、丝裂体追踪器红色(红色)和DAPI(蓝色)染色。虚线中线粒体和LC3的径向荧光强度曲线(右)。(B)GFP-Parkin转染后的Parkin(绿色)和线粒体(红色)的代表性图像。(C)对线粒体或细胞质部分的Parkin和PINK1的免疫印迹分析。(D)蛋白表达的定量分析(n = 3)。
由于钙稳态与内质网应激和线粒体损伤相关,研究人员试图确定钙稳态在软底物诱导的线粒体动力学改变和线粒体吞噬中的作用。通过共聚焦显微镜观察到,钙指示剂Cal520-AM在软基质上标记的细胞质游离钙的含量是玻璃基团的2倍以上(图7A)。这表明软底物触发了钙信号的激活。
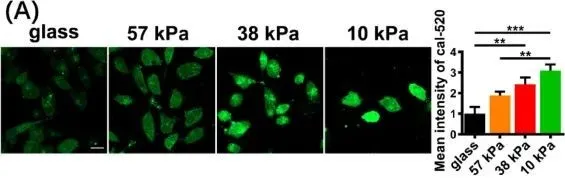
图7 软底物增加了Ca2+的浓度和振荡。(A)在不同硬度的基质上培养的MDA-MB-231细胞中胞质钙的代表性图像(左)和相应的平均荧光强度的定量图像(右,n = 3)。
线粒体钙超载是调节线粒体形态和功能改变的关键。研究人员进一步使用荧光Ca2+指示剂Rhod-2 AM标记线粒体钙,该指标显示软底物上的线粒体钙水平显著增加(图8A)。为了观察单细胞中的钙动力学,细胞分别转染了Mito-Gcamp6或ER-Gcamp6质粒。如图8B和C所示,共聚焦成像显示线粒体钙浓度增加,内质网钙浓度降低,提示软底物促进线粒体钙摄取和内质网钙释放。IP3R是激活ER-MITO钙转运通道的关键蛋白。如图8D和E所示,在软底细胞中,线粒体中的IP3R表达量显著增加。以上结果可以初步证明软底物促进ER-MITO接触和激活钙转运通道的运输。
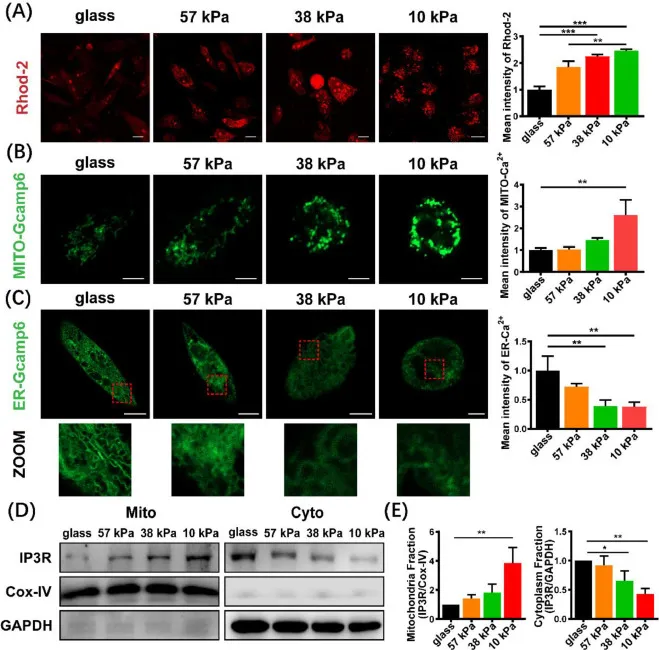
图8 软底物增强了内质网对线粒体Ca2+的摄取。(A)在不同硬度的基质上培养的MDA-MB-231细胞中线粒体钙的代表性共聚焦图像(左)和相应的平均荧光强度的定量。(B和C)转染Mito-Gcamp6或ER-Gcamp6 24小时的细胞中线粒体和内质网钙的代表性显微照片(左)和相应的平均荧光强度的定量。底部的面板显示了盒子区域的放大倍数。比例尺= 10 μm。(D)免疫blot分析线粒体或细胞质组分中的IP3R。(E)用ImageJ软件进行定量(n = 3)。
为了进一步探究内质网-线粒体钙转运信号和线粒体动力学之间的相关性,研究人员利用2APB(2-氨基乙基二苯硼酸酯)检测线粒体裂变和融合相关蛋白的表达水平,以阻断ER-MITO之间的钙转运。免疫荧光结果显示,2APB处理后,软基底上的细胞内Drp1与线粒体的共定位减少,破碎型线粒体部分恢复为伸长型线粒体,且线粒体数量和长度有所增加(图9B-C)。此外,2APB处理明显减弱了软基底介导的Parkin在线粒体膜处的聚集,且部分逆转了PINK1和Parkin的线粒体积累(图9D-F)。以上结果表明,软基底介导的内质网-线粒体钙转运存在线粒体动力学变化的上游,促进Drp1介导的线粒体分裂和自噬。
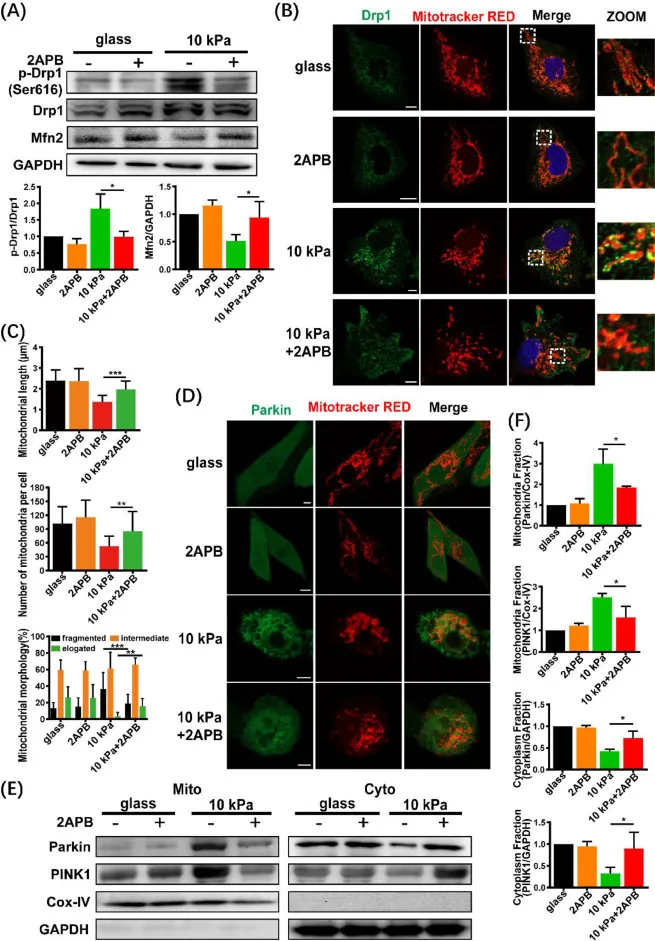
图9 ER-Mito钙转运介导线粒体裂变和线粒体吞噬。MDA-MB-231细胞在软(10 kPa)或玻璃基底物上培养,没有或存在2APB(50 μM)。线粒体裂变和融合蛋白(Drp1、磷酸化的Drp1-Ser616和Mfn2)的(A)蛋白印迹分析(左)和蛋白表达的定量分析(右)(n=3)。(B)用抗drp1抗体(绿色)、丝裂追踪器红色(红色)和DAPI(蓝色)染色的细胞的代表性显微照片。右边的放大图像显示了Drp1和线粒体共定位的细节。比例尺= 10 μm。(C)柱状图显示了平均线粒体长度(顶部)、线粒体数量(中间)和线粒体百分比,分为碎片、中间和细长形状(D)GFP-Parkin转染后的Parkin(绿色)和线粒体(红色)的代表性图像。比例尺= 10 μm。(E)Parkin和PINK1的Western blot分析。(F)蛋白表达的定量分析(n = 3)。
本研究揭示了力学刺激调控线粒体动力学的分子机制,有助于了解乳腺癌进展过程中钙稳态对线粒体动力学和线粒体自噬的影响,为靶向基质刚度的乳腺癌治疗提供参考信息和潜在的分子靶标。
参考文献
1. Shuang Zhang1,2,3, Lei Zeng1,2,3, Bing-Qian Su1,2,3, et al. The glycoprotein 5 of porcine reproductive and respiratory syndrome virus stimulates mitochondrial ROS to facilitate viral replication.Veterinary Microbiology | Research Article.November/December 2023 Volume 14 Issue 6
2. Yu Chena, Ping Li a, Xiangyan Chena, et al. Endoplasmic reticulum-mitochondrial calcium transport contributes to soft extracellular matrix-triggered mitochondrial dynamics and mitophagy in breast carcinoma cells. Acta Biomaterialia 169 (2023) 192–208

