
Origins and impact of extrachromosomal DNA
染色体外 DNA 的起源和影响
论文信息:Nature ( IF 50.5 ) Pub Date : 2024-11-06 , DOI: 10.1038/s41586-024-08107-3
主讲人:谭泽航,2025年6月3日
研究背景:
染色体外 DNA (ecDNA) 有助于肿瘤发生,是导致癌症患者治疗耐药和不良预后的主要因素。
本文研究了癌症中 ecDNA 与基因组的关系,揭示了频率、组织特异性、分子特征及其与治疗抵抗和预后的关系。
临床上,ecDNA 与肿瘤分期相关,在靶向治疗和细胞毒性治疗后更为普遍,并与转移和较短的总生存期相关。这些结果揭示了为什么 ecDNA 是一个重大的临床问题,它可以协同驱动肿瘤生长信号、改变转录景观并抑制免疫系统。
ecDNA 是人类癌症中扩增癌基因的常见来源单个 ecDNA 是大的(通常大于 500 kb)、可移动的、包含基因(和包含调节区)的环状 DNA 颗粒,可以在许多癌细胞的细胞核中找到。
细胞分裂过程中 ecDNA 的非染色体遗传和由此产生的随机分离促进高癌基因拷贝数和肿瘤内遗传异质性,促进基因组快速变化以驱动治疗耐药性ecDNA 的染色质高度可及,其环状结构导致基因调控结构改变,以及形成促进分子间合作的枢纽的倾向,产生高水平的致癌转录,有助于肿瘤发生ecDNA 可在肿瘤发生的早期出现,例如从 Barrett 高度异型增生转变为食管腺癌,并且在疾病进展的后期也被检测到由于 ecDNA 通过快速的基因组改变来驱动治疗耐药性,从而可能加速疾病进展,区分 ecDNA 与其他类型的局灶性扩增很重要。能够通过计算破译扩增的基因是否源自 ecDNA,并对其结构和序列进行反卷积,有助于检查人类癌症中的ecDNA含量。
研究意义与目的:
表明 ecDNA 不仅是扩增驱动癌基因的机制,而且还是经常扩增免疫调节和炎症基因的机制。此外,携带免疫调节基因的 ecDNA 与肿瘤 T 细胞浸润减少有关。还鉴定出仅携带增强子、启动子和 lncRNA 元件的 ecDNA,表明反式 ecDNA 之间相互作用的组合能力。同时,确定了与 ecDNA 相关的内在和环境突变过程,包括与其形成相关的突变过程。
研究内容:
Ecdna的介绍
非染色体遗传(Non-chromosomal Inheritance),又称细胞质遗传(Cytoplasmic Inheritance)或核外遗传(Extrachromosomal Inheritance),是指遗传物质存在于细胞质中(而非细胞核染色体上)的遗传方式。在细胞分裂时会随机分配进入子代细胞。这种随机性导致不同子代细胞中 ecDNA 的数量和种类可能存在很大差异,有的癌细胞可能获得较多的 ecDNA,而有的则可能几乎没有.由于 ecDNA 可以携带癌基因,如胶质母细胞瘤中的 EGFR 基因。在细胞分裂时,ecDNA 的随机分离使得癌基因有机会在子代细胞中不断累积,增加了癌基因的拷贝数。同时导致不同细胞中 ecDNA 的分布和组合不同,进而使肿瘤细胞在基因层面产生差异。这种遗传异质性使得肿瘤细胞在形态、功能、代谢等方面表现出多样性,部分细胞可能具有更强的增殖能力、侵袭能力或对环境的适应能力。
ecDNA(染色体外 DNA)的染色质高度可及是这种结构与线性的染色体 DNA 不同,它没有着丝粒和端粒等结构的限制,空间构象较为灵活,可能使得 DNA 序列更容易暴露,转录因子能够高效结合到癌基因的启动子和增强子区域,招募 RNA 聚合酶等转录相关蛋白,启动并增强癌基因的转录,从而使癌细胞中癌基因的表达量显著增加,促进肿瘤的发生和发展。
Ecdna的体图
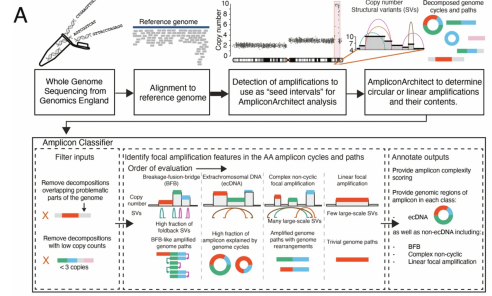
整体流程(上方主流程)
全基因组测序:获取样本,进行全基因组测序,得到 DNA 序列数据 。
比对参考基因组:将测序得到的 DNA 序列与已知 “参考基因组(Reference genome)” 进行比对,确定序列在基因组中的位置 。
确定种子区间:通过检测基因 “扩增(amplifications)” 情况,筛选出可作为 “种子区间(seed intervals)” 的区域,用于后续 AmpliconArchitect 分析 。
AmpliconArchitect 分析:用该工具分析基因扩增是 “环形(circular)” 还是 “线性(linear)”,以及明确扩增片段(amplifications)包含的基因内容,同时会涉及 “拷贝数(Copy number)” 和 “结构变异(Structural variants, SVs)” 分析 。
扩增子分类器(下方 Amplicon Classifier)
这是对扩增片段进一步分类解析的模块,分三步:
1.过滤输入(Filter inputs):
移除与基因组 “问题区域” 重叠的分解片段,避免干扰分析;,与基因组问题区域重叠的分解片段通常指通过分子生物学技术将基因组 DNA 切割或打断成较小片段后,其中与基因组中特定 “问题区域”(如突变位点、结构异常区域、致病区域或功能未知区域)存在序列重叠的 DNA 片段。
移除 “低拷贝数(<3 copies)” 的分解片段,聚焦有意义的扩增。
2.识别扩增特征(Identify focal amplification features):按顺序评估 4 类扩增特征,依据 “拷贝数”“结构变异” 等判断:
断裂 - 融合 - 桥(Breakage - fusion - bridge, BFB):有高比例 “折叠回文结构变异(foldback SVs)”,扩增路径呈 BFB 样;
染色体外 DNA(Extrachromosomal DNA, ecDNA):扩增片段多由 “基因组环(genome cycles)” 解释,常表现为环形扩增;
复杂非环形局灶性扩增(Complex non - cyclic focal amplification):含大量 “大规模结构变异(large - scale SVs)”,扩增伴随基因组重排;
线性局灶性扩增(Linear focal amplification):大规模结构变异少,扩增路径接近 “简单基因组路径(Trivial genome paths)” 。
3.注释输出(Annotate outputs):
给扩增片段做 “复杂性评分(amplicon complexity scoring)”;
标注各类扩增对应的 “基因组区域”,区分出 ecDNA,以及 BFB、复杂非环形、线性局灶性扩增等非 ecDNA 类型 。
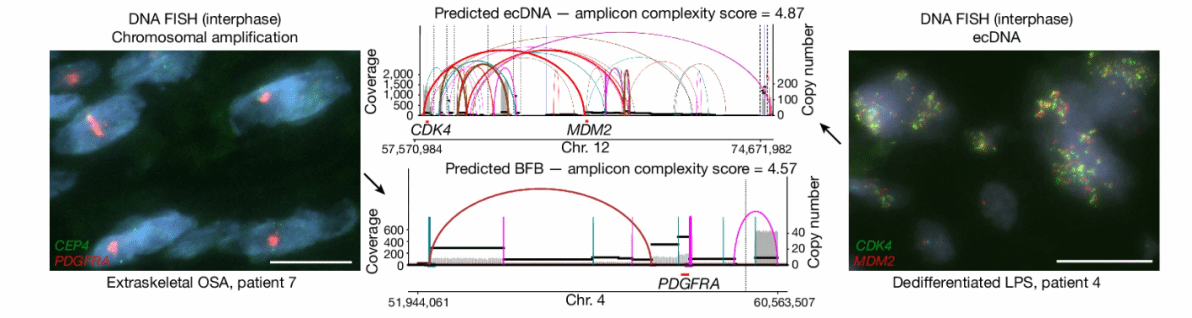
这是关于 肿瘤基因组扩增模式 的研究图,:
技术:DNA FISH(间期荧光原位杂交)、基因组覆盖度(Coverage)与拷贝数(Copy number)分析
左侧:骨外骨肉瘤,染色体扩增
右侧:去分化脂肪肉瘤,ecDNA
ecDNA 扩增(上方)涉及基因:CDK4、MDM2(位于 12 号染色体)
复杂度评分(amplicon complexity score):4.87,呈现复杂的基因组环化、拷贝数波动
BFB 扩增(下方,断裂 - 融合 - 桥循环):涉及基因:PDGFRA(位于 4 号染色体)
复杂度评分:4.57,体现染色体断裂修复异常导致的扩增
对比两种肿瘤样本的基因组扩增模式:
染色体扩增(左侧):信号集中在染色体区域(红色、绿色斑点对应 CEP4、PDGFRA )
ecDNA 扩增(右侧):信号呈分散的 “斑点簇”,代表游离于染色体外的环状 DNA 大量复制
总结与展望:
随着 ecDNA 通过基因剂量的快速生成和微调对肿瘤内异质性、耐药性和不良生存率的贡献变得越来越明显,确定治疗脆弱性和确定目标化合物以限制 ecDNA 进化和维持的重要且持续的挑战将适用于整个泛癌领域
深入解析形成机制:尽管已提出多种 ecDNA 形成模型,如染色体碎裂、轻度 DNA 损伤、附加体模型、断裂 - 融合 - 桥循环、易位 - 缺失 - 扩增模型及叉停滞和模板转换等,但确切机制仍不明晰。未来需结合高分辨率成像技术、单细胞测序及基因编辑技术,在更多物种和细胞类型中验证并完善这些模型,明确不同条件下 ecDNA 形成的主导途径及关键调控因子。

