
我院何祖平研究团队最新研究发现,唯支持细胞综合征与正常人类睾丸支持细胞具有不同的蛋白表达谱,并且SPARC/FGF2/CDH1调控通路在人类支持细胞中发挥重要作用。相关成果以“Micro-proteomics reveals distinct protein profiles and SPARC/FGF2/CDH1 regulation of human Sertoli cells between Sertoli cell-only syndrome and normal men”为题发表在《Cellular and Molecular Life Sciences》上。
唯支持细胞综合征(Sertoli cell-only syndrome, SCOS)是非梗阻性无精子症(non-obstructive azoospermia, NOA)中最严重的类型之一,其特征为生精小管内仅有支持细胞而无任何生精细胞,导致完全丧失精子生成能力及男性不育。因此揭示SCOS中支持细胞的蛋白表达谱对该疾病的诊疗策略具有重要意义。
由于获取足量人类睾丸组织困难,传统蛋白质组学难以比较SCOS患者与正常男性支持细胞的大规模蛋白质表达谱。为解决这一难题,我们采用仅需1-100个细胞的微量蛋白质组学技术,揭示SCOS患者与梗阻性无精子症(OA)患者(具有正常生精功能)之间支持细胞的蛋白质组差异。在收集SCOS与OA睾丸组织后,我们使用两步酶消化法结合差异贴壁提取支持细胞,并对提取的支持细胞进行鉴定,随后进行微量蛋白质组学(图1)。
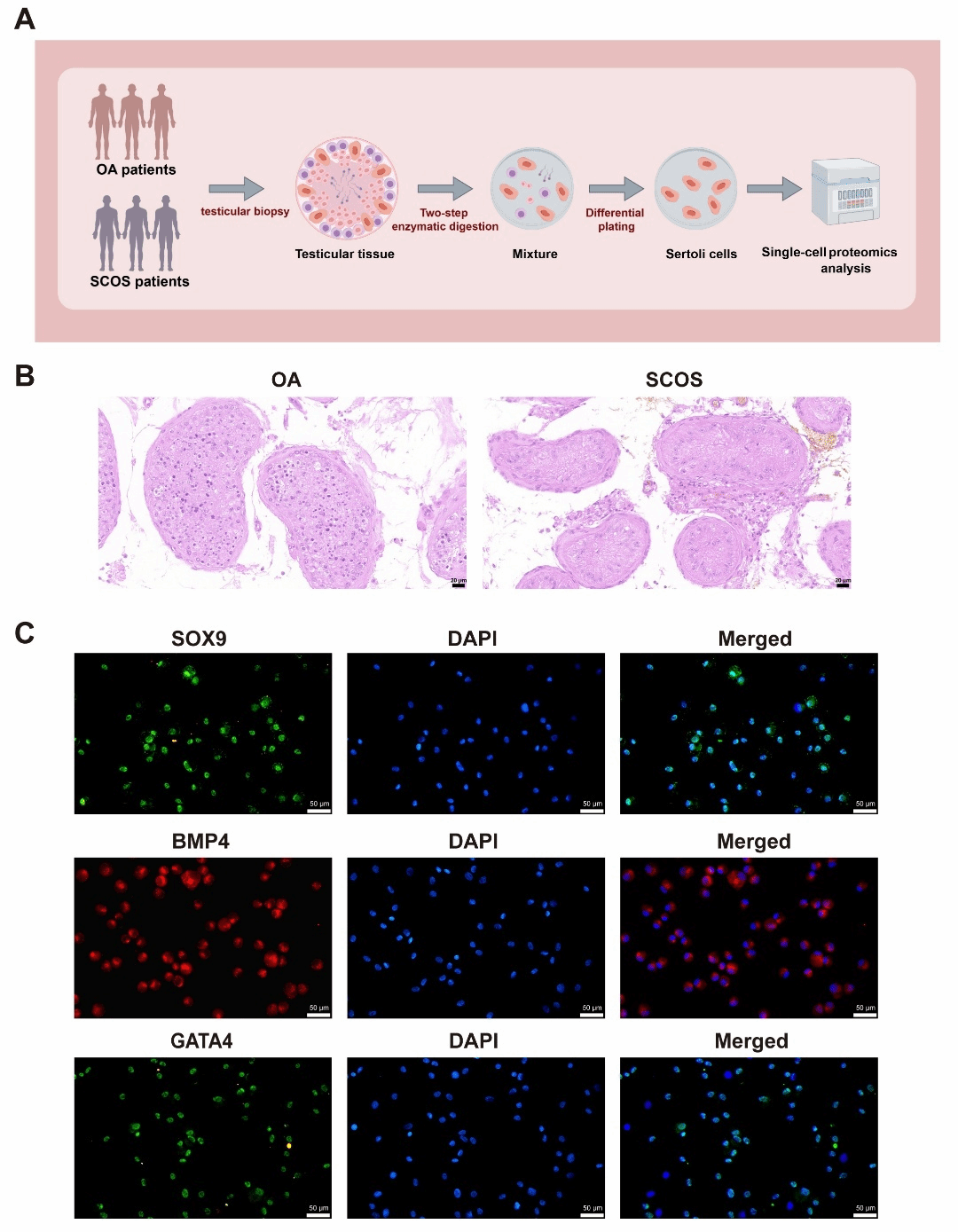
图1. 分离和鉴定SCOS和OA患者睾丸组织中的人类支持细胞
微量蛋白质组学显示,SCOS与OA支持细胞的蛋白质组存在显著差异。火山图显示共有1520个蛋白上调,158个蛋白下调(Fold change≥2.0或≤0.5,p<0.05)。GO分析表明,上调的蛋白主要富集于mRNA 剪接、翻译和细胞内蛋白转运;下调蛋白则集中于细胞黏附、蛋白水解和血管生成(图2)。

图2. 微量蛋白质组学揭示了 SCOS 与 OA 患者支持细胞的蛋白质表达谱
我们进一步发现,SCOS患者的支持细胞中富含半胱氨酸的酸性分泌蛋白(Secreted Protein Acidic and Rich in Cysteine,SPARC)蛋白水平显著降低。SPARC的敲除明显抑制了支持细胞标志物,包括SOX9和GDNF的基因和蛋白表达水平。值得注意的是,我们发现FGF2 mRNA和蛋白在SPARC沉默后上调。在共聚焦显微镜下,我们观察到支持细胞中 SPARC 与 FGF2 的共定位。这提示SPARC可能通过调控FGF2的表达进而发挥功能(图3)。
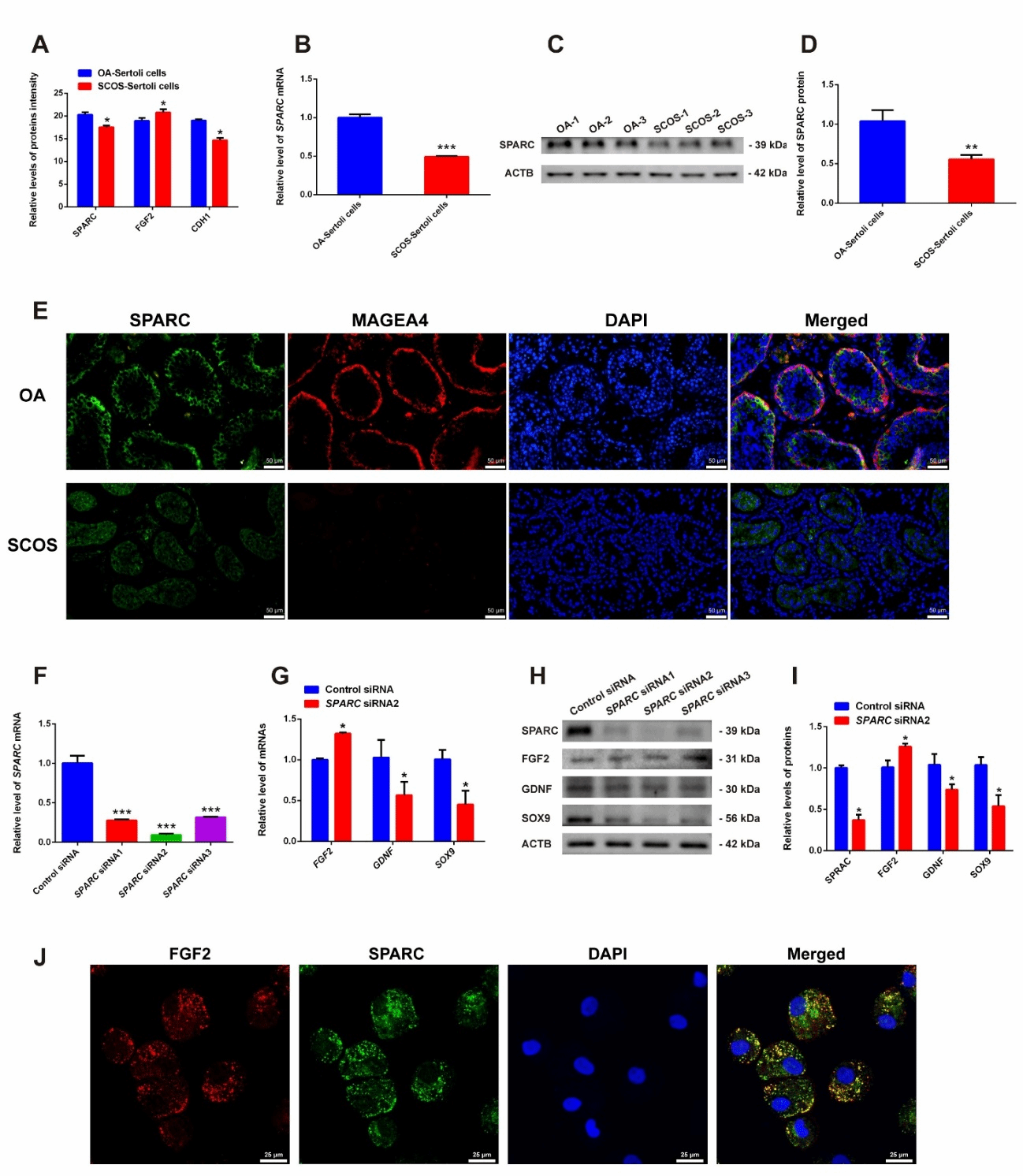
图3. SPARC在SCOS患者的支持细胞中低表达
随后,我们探索 SPARC 是否参与调控人类支持细胞的功能。我们发现SPARC敲低可明显增加支持细胞的凋亡并引起细胞黏附能力的下降。SPARC敲低引起ITGA5、COL6A1等黏附相关基因表达下降,并导致紧密连接蛋白ZO-1和钙粘蛋白CDH1的膜定位减弱(图4)。
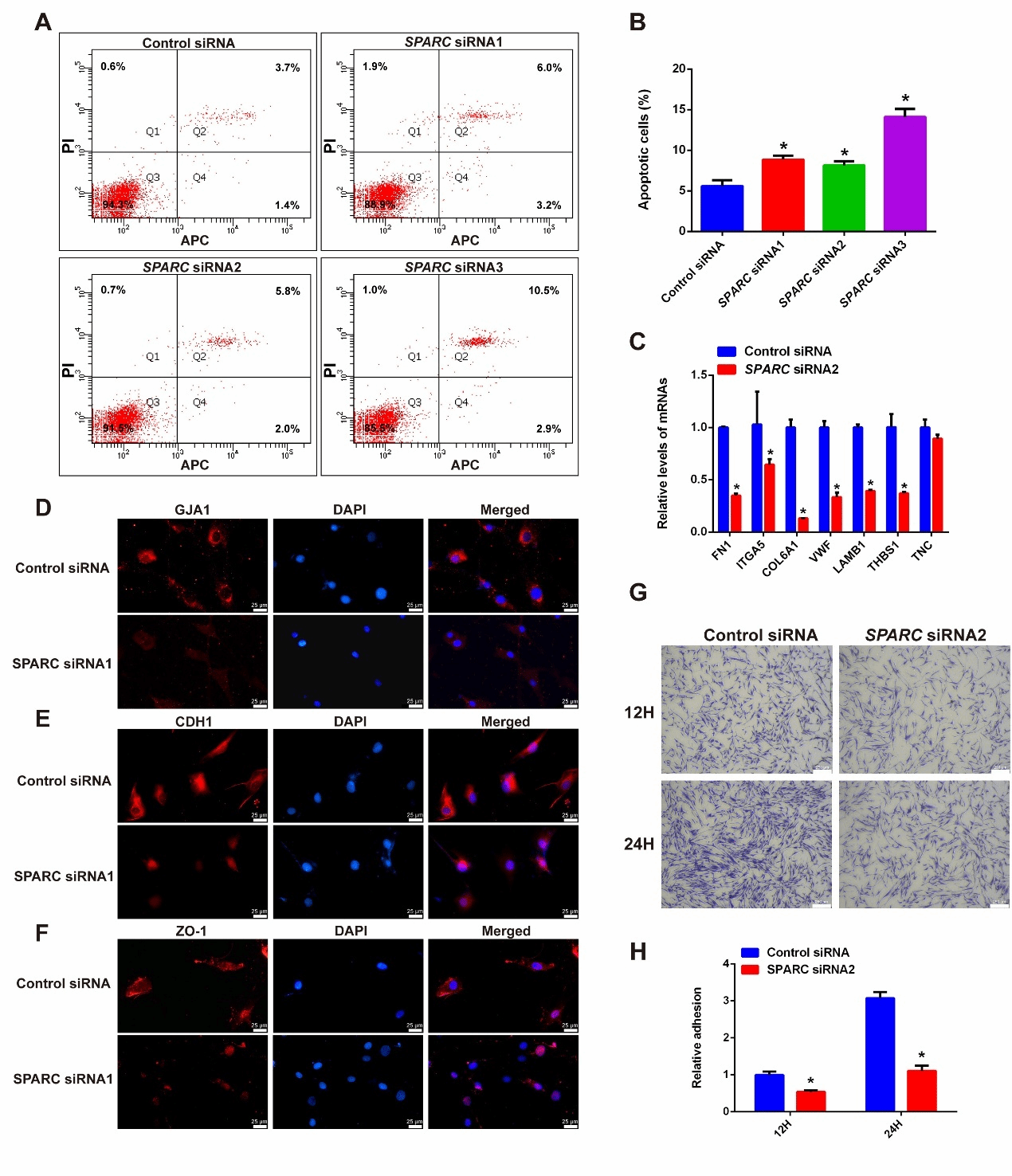
图4. SPARC缺失导致支持细胞功能异常
通过免疫细胞化学,我们观察到 SCOS 患者的支持细胞中,支持细胞标记物FGF2和 WT1蛋白表达水平显著升高,而GDNF蛋白表达下降(图5)。

图5. FGF2 在 SCOS 患者的支持细胞中高度表达
为阐释FGF2在SCOS患者病理过程中的作用机制,我们通过文献挖掘发现FGF2可通过负向调控CDH1表达水平削弱细胞间黏附功能,这一发现与我们的蛋白质组学结果高度吻合,SCOS患者支持细胞中CDH1蛋白表达显著降低。随后,我们观察到人支持细胞中CDH1 mRNA与蛋白在FGF2敲除后升高,而在FGF2过表达时发生降低。进一步细胞黏附实验表明FGF2的表达影响支持细胞的黏附能力,这提示我们FGF2可能通过调控CDH1的表达影响支持细胞的正常功能(图6)。
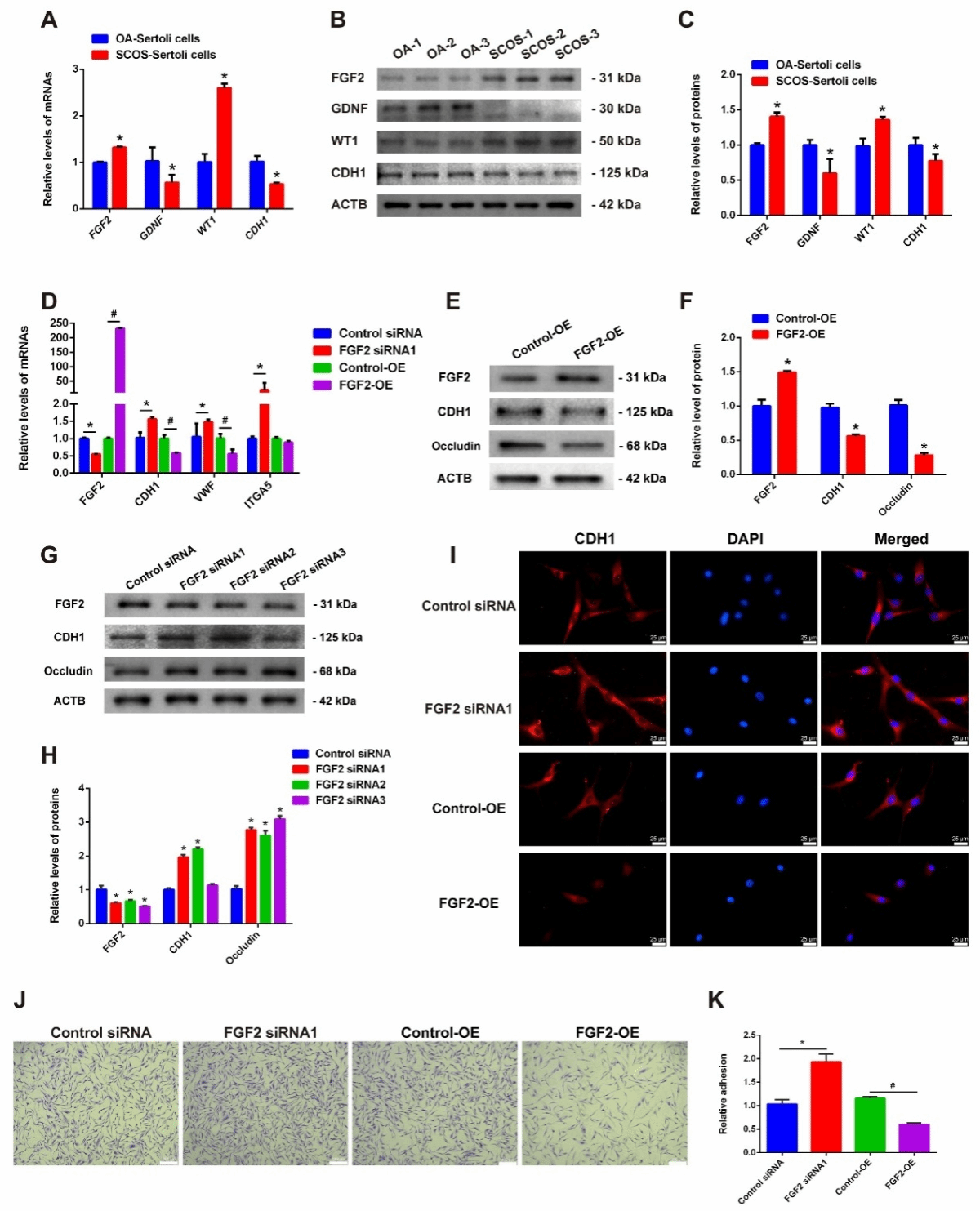
图6. FGF2降低了支持细胞的粘附能力
随后我们发现SCOS 患者的支持细胞凋亡率明显高于 OA 患者。TUNEL染色和线粒体膜电位检测进一步证实凋亡激活。此外,透射电镜结果显示SCOS 患者的支持细胞表现出明显的内质网扩张,膜裂解增加,凋亡小体增加。GSEA分析显示凋亡相关通路显著富集。以上结果提示,与OA组相比,SCOS患者的支持细胞凋亡显著增加(图7)。
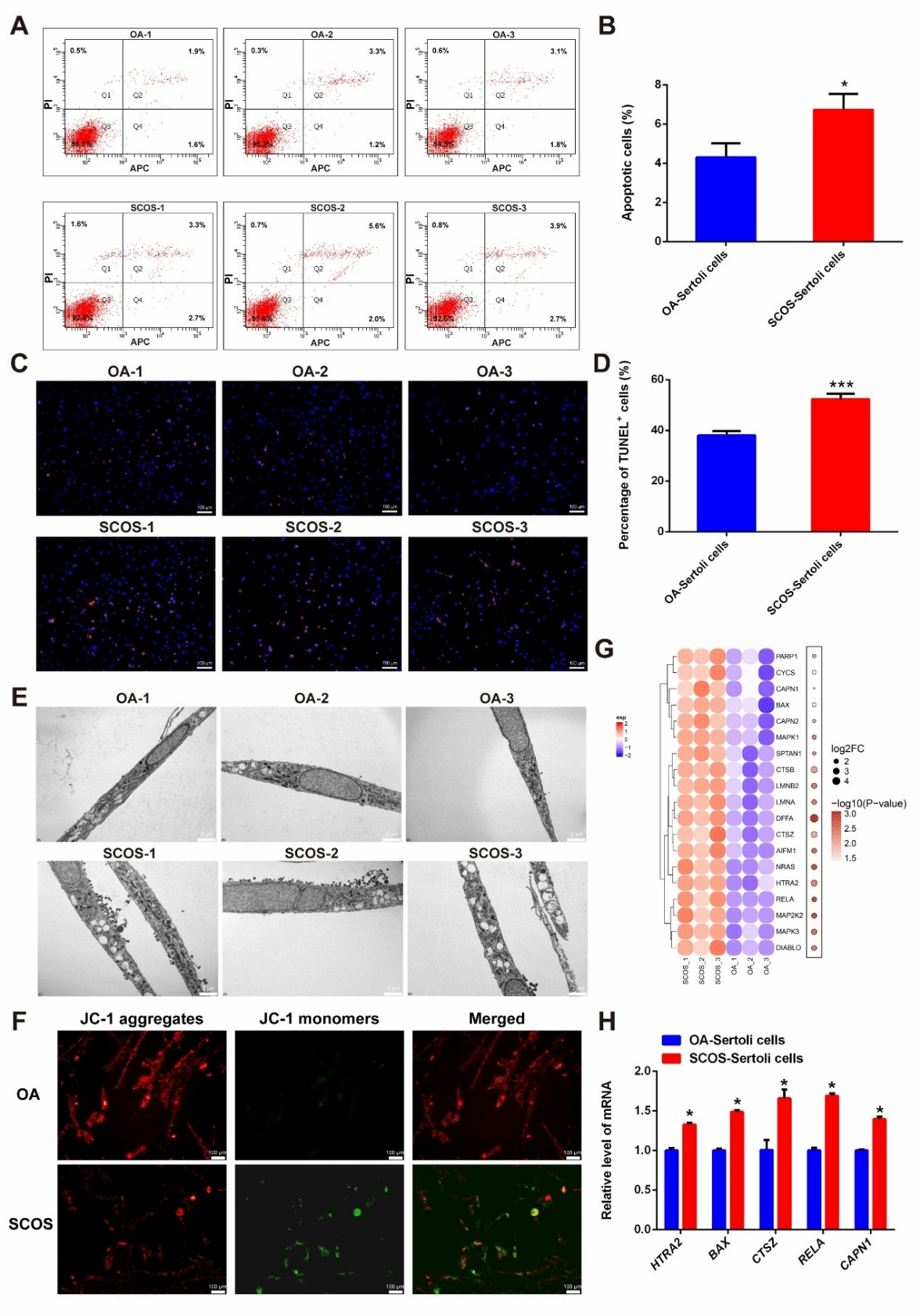
图7. SCOS患者睾丸支持细胞的凋亡增加
本研究首次运用微量蛋白质组学技术,系统解析了SCOS患者支持细胞的蛋白谱,揭示了SPARC/FGF2/CDH1信号轴的异常调控可能构成SCOS的致病机制。基于此,我们提出SPARC可能作为SCOS的潜在诊断生物标志物及治疗靶点,本研究为开发针对SCOS及男性不育症的精准诊疗策略提供了重要的理论依据和创新视角。
原文链接:DOI: 10.1007/s00018-025-05678-w
通讯作者:

何祖平 教授
(海南省医学科学院 PI)
何祖平,博士,二级教授,海南医科大学C类人才,海南省医学科学院PI,博士生导师。入选上海高校特聘教授(东方学者)、湖湘高层次人才聚集工程-杰出创新人才、上海市浦江人才计划。历任美国乔治城大学助理教授,上海交通大学研究员(三级技术岗位)、博士生导师、上海市男科学研究所所长,湖南师范大学医学院院长、二级教授、“潇湘学者”特聘教授、博士生导师。主持国家自然科学基金重点项目、国家重点研发计划课题、国家重大科学研究课题(2项)、国家自然科学基金面上项目(5项)等科研项目12项。长期从事生殖干细胞的遗传与表观遗传机制及其临床转化应用研究。其研究成果发表在国际著名期刊,如Cell Death & Differentiation、Research、Cell Death & Disease等。他以通讯作者或第一作者已发表SCI收录论文94篇,获得湖南省自然科学奖二等奖。


